PRESENTACIÓN Y ACCIÓN TERAPÉTICA
FÓRMULA CUALI-CUANTITATIVA:
Cada cápsula dura de DUODART® contiene una cápsula blanda de Dutasteride 0,5 mg y pellets de Clorhidrato de Tamsulosina 0,4 mg (equivalentes a 0,367 mg de tamsulosina).
Cada cápsula dura contiene:
Cuerpo: Carragenano E407 ≤1,3 mg; Cloruro de potasio ≤0,8 mg; Dióxido de titanio E171 aprox. 1 mg; Óxido de hierro rojo E172 aprox. 5 mg; Agua purificada aprox. 5 mg; Hipromelosa c.s.p. 100 mg. Tapa: Carragenano E407 ≤1,3 mg; Cloruro de potasio ≤0,8 mg; Dióxido de titanio E171 aprox. 6 mg; Amarillo 6 FD&C E110 aprox. 0,1 mg; Agua purificada aprox. 5 mg; Hipromelosa c.s.p. 100 mg; Tinta negra aprox. 0,05 mg. Otros: Cera carnauba c.s.; Almidón de maíz c.s.
Cada cápsula blanda de Dutasteride contiene:
Dutasteride 0,50 mg; Mono y diglicéridos del ácido caprílico/cáprico 299,47 mg; Butilhidroxitolueno 0,03 mg; Gelatina 116,11 mg; Glicerol 66,32 mg; Dióxido de Titanio E171 1,29 mg; Óxido de hierro amarillo E172 0,13 mg; Agua purificada c.s. (*); Triglicéridos de cadena media c.s.; Lecitina c.s.
Composición del pellet de Clorhidrato de Tamsulosina (mg/cápsula dura):
Núcleo: Clorhidrato de Tamsulosina 0,40 mg; Celulosa microcristalina 138,25 mg; Ácido metacrílico-copolímero del acrilato etílico 8,25 mg; Talco 8,25 mg; Trietilcitrato 0,825 mg; Agua purificada c.s.(*). Recubrimiento: Ácido metacrílico-copolímero del acrilato etílico 10,40 mg; Talco 4,16 mg; Trietilcitrato 1,04 mg; Agua purificada c.s.(*)
(*) El agua purificada desaparece durante el proceso de secado del pellet.
Excipientes de efectos conocidos: cada cápsula contiene lecitina (que puede contener aceite de soja) y amarillo E110. Cada cápsula contiene menos de ≤0.1 mg de amarillo E110.
ACCIÓN TERAPÉUTICA:
Antagonistas de los receptores alfa-adrenérgicos (Código ATC G04CA52, grupo terapéutico al que pertenece tamsulosina en combinación con dutasteride).
INDICACIONES:
Tratamiento de los síntomas moderados a severos de la Hiperplasia Prostática Benigna (HPB).
Reducción en el riesgo de Retención Urinaria Aguda (RUA) y cirugía en pacientes con síntomas moderados a severos de HPB.
PROPIEDADES FARMACOLÓGICAS:
Propiedades farmacodinámicas:
Dutasteride-tamsulosina es una combinación de dos fármacos: Dutasteride, un inhibidor dual de la 5-α-reductasa (5 ARI) y clorhidrato de tamsulosina, un antagonista de adrenorreceptores α1a y α1d. Estos fármacos tienen mecanismos de acción complementarios que mejoran rápidamente los síntomas, el flujo urinario y reducen el riesgo de Retención Urinaria Aguda (RUA) y la necesidad de cirugía relacionada con HPB.
Dutasteride inhibe tanto las isoenzimas de 5-α-reductasa tipo 1 y tipo 2, que son responsables de la conversión de testosterona a dihidrotestosterona (DHT). DHT es el andrógeno principal responsable del crecimiento de la próstata y el desarrollo de la HPB. La tamsulosina inhibe los receptores adrenérgicos α1a y α1d en el músculo liso del estroma prostático y cuello de la vejiga. Aproximadamente el 75% de los α1-receptores en la próstata son del subtipo α1a.
Propiedades farmacocinéticas:
Se demostró la bioequivalencia entre la combinación de dutasteride-tamsulosina y la dosificación concomitante con cápsulas separadas de dutasteride y tamsulosina.
El estudio de bioequivalencia de dosis única se realizó tanto en el estado de ayuno como postprandial. Se observó una reducción del 30% en la Cmáx del componente tamsulosina de dutasteride-tamsulosina en estado postprandial en comparación con el estado de ayuno. Los alimentos no tuvieron ningún efecto sobre el ABC (Área Bajo la Curva) de tamsulosina.
Absorción
Dutasteride: Tras la administración oral de una dosis única de 0,5 mg de dutasteride, el tiempo al pico de concentraciones séricas de dutasteride es de 1 a 3 horas. La biodisponibilidad absoluta es aproximadamente del 60%. La biodisponibilidad de dutasteride no se ve afectada por los alimentos.
Tamsulosina: Se absorbe desde el intestino y es casi completamente biodisponible. Tanto la tasa y grado de absorción de la tamsulosina se reducen cuando se toma dentro de los 30 minutos luego de una comida. La uniformidad de la absorción puede ser promovida por el paciente tomando DUODART® siempre después de la misma comida. La tamsulosina muestra una exposición en plasma proporcional a la dosis.
Después de una dosis única de tamsulosina en el estado postprandial, las concentraciones plasmáticas de tamsulosina hacen un pico alrededor de las 6 horas y, en el estado estacionario, que se alcanza para el día 5 de dosificación múltiple, la Cmáx media en estado estacionario en pacientes es alrededor de dos tercios más alta que la alcanzada después de una dosis única. Aunque esto se observó en pacientes ancianos, también se esperaría el mismo hallazgo en pacientes más jóvenes.
Distribución
Dutasteride: Tiene un gran volumen de distribución (300 a 500 l) y se une altamente a las proteínas plasmáticas (>99,5%). Después de la dosificación diaria, las concentraciones de dutasteride en suero alcanzan el 65% de la concentración en estado estacionario después de 1 mes y aproximadamente el 90% después de 3 meses.
Se alcanzan concentraciones séricas del estado estacionario (Css) de aproximadamente 40 ng/ml después de 6 meses de dosificación con 0,5 mg una vez al día. La partición de dutasteride desde suero a semen promedia un 11,5%.
Tamsulosina: En el hombre, tamsulosina está unida a las proteínas plasmáticas alrededor del 99%. El volumen de distribución es pequeño (alrededor de 0,2 l/kg).
Metabolismo
Dutasteride: Se metaboliza ampliamente in vivo. In vitro, dutasteride se metaboliza mediante el citocromo P450 3A4 y 3A5 a tres metabolitos monohidroxilados y un metabolito dihidroxilado.
Tras la dosificación oral de dutasteride 0,5 mg/día para el estado estacionario, un 1,0% a 15,4% (media de 5,4%) de la dosis administrada se excreta en forma de dutasteride inalterada en las heces. El resto se excreta en las heces como 4 metabolitos principales que comprenden el 39%, 21%, 7% y 7% de cada uno de los materiales relacionados con el fármaco y 6 metabolitos menores (menos del 5% cada uno). Sólo se detectan cantidades traza de dutasteride sin modificar (menos del 0,1% de la dosis) en la orina humana.
Tamsulosina: No hay bioconversión enantiomérica del [isómero R(-)] de clorhidrato de tamsulosina al isómero S(+) en los seres humanos. El clorhidrato de tamsulosina se metaboliza ampliamente mediante las enzimas del citocromo P450 en el hígado y menos del 10% de la dosis se excreta en la orina sin cambios. Sin embargo, no se ha establecido el perfil farmacocinético de los metabolitos en humanos. Los resultados in vitro indican que CYP3A4 y CYP2D6 están involucrados en el metabolismo de la tamsulosina, así como algunas otras isoenzimas CYP de menor participación. La inhibición de las enzimas hepáticas que metabolizan el fármaco puede conducir a exposición aumentada a tamsulosina (Ver ADVERTENCIAS Y PRECAUCIONES e Interacción con otros medicamentos y otras formas de interacción). Los metabolitos del clorhidrato de tamsulosina sufren una conjugación extensa con glucuronato o sulfato antes de su excreción renal.
Eliminación
Dutasteride: La eliminación de dutasteride es dependiente de la dosis y el proceso parece ser descrito por dos vías de eliminación en paralelo, una que es saturable a concentraciones clínicamente relevantes y una que es no saturable.
A concentraciones séricas bajas (menos de 3 ng/ml), dutasteride es depurada rápidamente tanto por la vía de eliminación dependiente de la concentración como por la independiente de la concentración. Dosis únicas de 5 mg o menos mostraron evidencia de depuración rápida y una vida media corta de 3 a 9 días.
A concentraciones terapéuticas, tras dosis repetidas de 0,5 mg/día, la vía de eliminación lineal, más lenta, es la dominante y la vida media es de aproximadamente 3 a 5 semanas.
Tamsulosina: La tamsulosina y sus metabolitos son excretados principalmente en la orina con alrededor del 9% de la dosis presente en forma de la sustancia activa sin modificar.
Tras la administración endovenosa u oral de una formulación de liberación inmediata, la vida media de eliminación de tamsulosina en plasma varía de 5 a 7 horas. Debido a la farmacocinética controlada por la tasa de absorción con cápsulas de tamsulosina de liberación modificada, la vida media de eliminación aparente de tamsulosina en el estado postprandial es aproximadamente 10 horas y en el estado estacionario en pacientes es de aproximadamente 13 horas.
Ancianos
Dutasteride: Se evaluó la farmacocinética de dutasteride en 36 sujetos varones sanos de edades entre 24 y 87 años tras la administración de una dosis única de 5 mg de dutasteride. No se observó ninguna influencia significativa de la edad sobre la exposición de dutasteride pero la vida media fue más corta en hombres de menos de 50 años de edad. La vida media no fue estadísticamente diferente al comparar el grupo de 50-69 años con el grupo de mayores de 70 años.
Tamsulosina: Un estudio de comparación cruzada de exposición general a clorhidrato de tamsulosina (ABC) y vida media indica que la exposición farmacocinética de clorhidrato de tamsulosina puede estar ligeramente prolongada en hombres ancianos en comparación con voluntarios hombres jóvenes, sanos. El clearance intrínseco es independiente de la unión de clorhidrato de tamsulosina a AAG (del inglés Alfa-1-acid glycoprotein), pero disminuye con la edad, dando como resultado una exposición un 40% más alta (ABC) en sujetos de 55 a 75 años de edad en comparación con sujetos de 20 a 32 años de edad.
Insuficiencia renal
Dutasteride: No se estudió el efecto de la insuficiencia renal sobre la farmacocinética de dutasteride. Sin embargo, en orina humana se recupera menos del 0,1% de una dosis de 0,5 mg en el estado estacionario de dutasteride, por lo que no se anticipa ningún aumento clínicamente significativo de las concentraciones plasmáticas de dutasteride para los pacientes con insuficiencia renal (Ver POSOLOGÍA Y MODO DE ADMINISTRACIÓN).
Tamsulosina: Se compararon las farmacocinéticas de clorhidrato de tamsulosina en 6 sujetos con insuficiencia renal leve-moderada (30≤Clcr<70 ml/min/1,73 m2) o moderada-grave (10≤Clcr<30 ml/min/1,73 m2) y 6 sujetos normales (Clcr >90 ml/min/1,73 m2). Mientras que se observó un cambio en la concentración plasmática general de clorhidrato de tamsulosina como resultado de la unión alterada a AAG, la concentración de clorhidrato de tamsulosina libre (activo), así como el clearance intrínseco, permaneció relativamente constante. Por lo tanto, los pacientes con insuficiencia renal no requieren un ajuste en la dosificación de cápsulas de clorhidrato de tamsulosina. Sin embargo, no se estudiaron pacientes con enfermedad renal en etapa terminal (Clcr<10 ml/min/1,73 m2).
Insuficiencia hepática
Dutasteride: No se ha estudiado el efecto de la insuficiencia hepática sobre la farmacocinética de dutasteride (Ver CONTRAINDICACIONES). Debido a que dutasteride se elimina principalmente a través del metabolismo se espera que los niveles plasmáticos en estos pacientes sean elevados y la vida media sea prolongada (Ver POSOLOGÍA Y MODO DE ADMINISTRACIÓN y ADVERTENCIAS Y PRECAUCIONES).
Tamsulosina: La farmacocinética del clorhidrato de tamsulosina se comparó en 8 sujetos con disfunción hepática moderada (Clasificación de Child-Pugh: Grados A y B) y 8 sujetos normales. Mientras que se observó un cambio en la concentración plasmática general de clorhidrato de tamsulosina como resultado de una unión alterada a AAG, la concentración de clorhidrato de tamsulosina libre (activo) no cambia significativamente con sólo un cambio modesto (32%) en el clearance intrínseco del clorhidrato de tamsulosina libre. Por lo tanto, los pacientes con disfunción hepática moderada no requieren un ajuste en la dosificación de clorhidrato de tamsulosina. El clorhidrato de tamsulosina no se estudió en pacientes con disfunción hepática severa.
Estudios Clínicos:
Coadministración de dutasteride con tamsulosina
No se han realizado estudios clínicos con DUODART®. Las siguientes declaraciones reflejan la información disponible sobre la terapia de co-administración con dutasteride y tamsulosina.
Dutasteride 0,5 mg/día (n=1.623), tamsulosina 0,4 mg/día (n=1.611) o la co-administración de dutasteride 0,5 mg y tamsulosina 0,4 mg (n=1.610) fueron evaluados en varones con síntomas moderados a severos de HPB que tenían próstatas ≥30 ml y un valor de PSA dentro del rango de 1,5 a 10 ng/ml en un estudio multicéntrico de 4 años, multinacional, randomizado a doble ciego, de grupos paralelos. Aproximadamente el 53% de los sujetos tuvo una exposición previa a un inhibidor de la 5-α-reductasa o tratamiento con un antagonista de adrenorreceptor alfa1. El criterio primario de valoración de eficacia durante los primeros 2 años de tratamiento fue el cambio en la Puntuación Internacional de Síntomas de Próstata (IPSS, por sus siglas en inglés), un instrumento de 8 ítems basado en AUA-SI (por sus siglas en inglés Índice de Síntomas de la Asociación Urológica Americana) con una pregunta adicional sobre la calidad de vida. Los criterios secundarios de valoración de eficacia a los dos años incluyeron la tasa máxima del flujo urinario (Qmáx) y el volumen de la próstata. La combinación logró una diferencia con significancia estadística para IPSS al mes 3 comparado con dustasteride y al mes 9 comparado con tamsulosina. La combinación logró una diferencia con significancia estadística para Qmáx al mes 6 comparado con dutasteride y tamsulosina.
La combinación de dutasteride y tamsulosina proporciona una mejoría superior en los síntomas que cada componente por separado. Después de 2 años de tratamiento, la terapia de la co-administración mostró una mejoría media ajustada estadísticamente significativa en las puntuaciones de los síntomas a partir de la condición inicial de -6,2 unidades.
La mejoría media ajustada en la tasa de flujo comparada con la condición inicial fue 2,4 ml/seg para la terapia conjunta, 1,9 ml/seg para el dutasteride y 0,9 ml/seg para la tamsulosina. La mejoría media ajustada en el índice de impacto BPH (BII) comparada con el nivel basal fue -2,1 unidades para la terapia conjunta, -1,7 para dutasteride y -1,5 para tamsulosina.
Estas mejorías en la tasa de flujo y en el índice de impacto de HPB fueron estadísticamente significativas para la terapia de co-administración en comparación con ambas monoterapias.
La reducción en el volumen prostático total y el volumen de la zona de transición después de 2 años de tratamiento fue estadísticamente significativa para la terapia de co-administración comparada con la monoterapia de tamsulosina sola.
El criterio primario de eficacia a los 4 años de tratamiento fue el tiempo al primer evento de RUA o cirugía relacionada con HPB. Luego de 4 años de tratamiento, el tratamiento en combinación redujo de manera estadísticamente significativa el riesgo de RUA o de cirugía relacionada con HPB (65,8% de reducción en el riesgo p<0,001 [IC 95%: 54,7% a 74,1%]) comparado con la monoterapia de tamsulosina. La incidencia de RUA o de cirugía relacionada con HPB al año 4 fue 4,2% para el tratamiento en combinación y 11,9% para tamsulosina (p<0,001). Comparado con la monoterapia de dutasteride, el tratamiento en combinación redujo el riesgo de RUA o cirugía relacionada con HPB en un 19,6% (p=0,18 [IC 95%: -10,9% a 41,7%]). La incidencia de RUA o cirugía relacionada con HPB al año 4 fue 5,2% para dutasteride.
Los criterios de valoración secundarios luego de 4 años de tratamiento incluyeron el tiempo a la progresión clínica (definida como un compuesto de: deterioro de IPSS en ≥ 4 puntos, eventos de RUA relacionados con HPB, incontinencia, infección del tracto urinario (ITU), e insuficiencia renal) cambio en IPSS, tasa máxima del flujo urinario (Qmáx) y el volumen de la próstata. IPSS es un instrumento de 8 ítems basado en AUA-SI con una pregunta adicional sobre la calidad de vida. Los resultados tras 4 años de tratamiento se presentan a continuación:
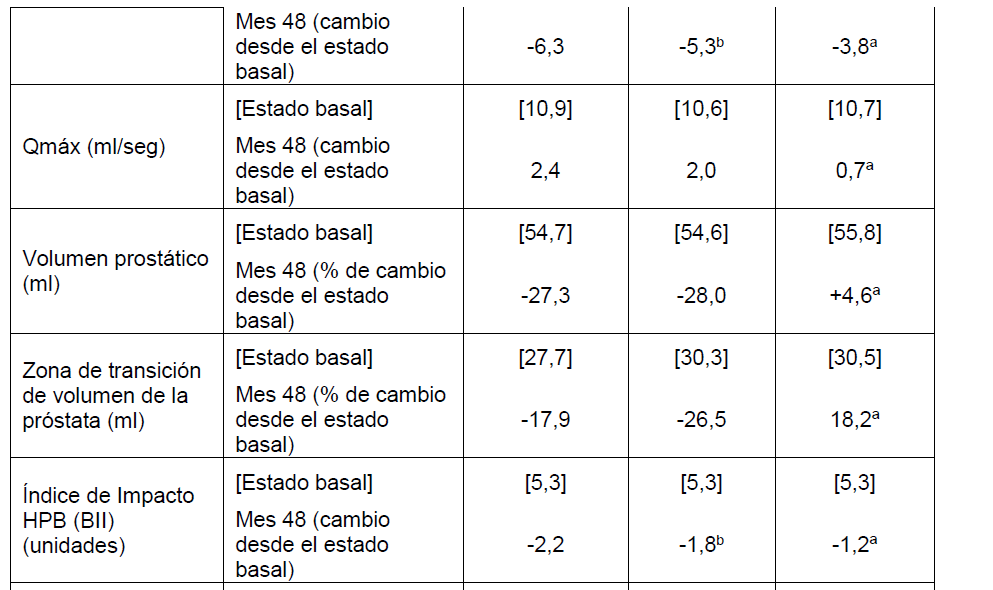

Los valores del estado basal son valores medios y los cambios desde el estado basal son ajustados a cambios medios.
*La progresión clínica fue definida como un compuesto de: deterioro de IPSS en ≥ 4 puntos, eventos de RUA relacionados con HPB, incontinencia, ITU, e insuficiencia renal.
aLa combinación logró una diferencia con significancia estadística (p<0,001) versus tamsulosina al Mes 48.
bLa combinación logró una diferencia con significancia estadística (p<0,001) versus dutasteride al Mes 48.
Dutasteride
Dutasteride 0,5 mg/día o placebo se evaluó en 4.325 sujetos varones con síntomas moderados a severos de HPB que tenían próstatas ≥30 ml y un valor de PSA en el rango de 1,5 a 10 ng/ml, en tres estudios de eficacia primaria de 2 años de duración, multicéntricos, multinacionales, controlados con placebo, a doble ciego. Los estudios luego continuaron con una extensión abierta a 4 años con todos los pacientes que permanecieron en el estudio recibiendo dutasteride a la misma dosis de 0,5 mg. El 37% de los pacientes inicialmente randomizados a placebo y el 40% de los pacientes randomizados a dutasteride permanecieron en el estudio los 4 años. La mayoría (71%) de los 2.340 sujetos en las extensiones abiertas completaron los 2 años adicionales de tratamiento abierto.
Los parámetros clínicos más importantes de eficacia fueron el AUA-SI, el flujo urinario máximo (Qmáx) y la incidencia de Retención Urinaria Aguda y cirugía relacionada con la HPB.
AUA-SI es un cuestionario de siete preguntas sobre los síntomas relacionados con HPB con una puntuación máxima de 35. Al inicio del estudio la puntuación promedio fue de aproximadamente 17. Después de seis meses, uno y dos años de tratamiento el grupo placebo tuvo una mejoría media de 2,5; 2,5 y 2,3 puntos respectivamente, mientras que el grupo Avodart® mejoró 3,2; 3,8 y 4,5 puntos respectivamente. Las diferencias entre los grupos fueron estadísticamente significativas. La mejoría evidenciada en el AUA-SI durante los primeros 2 años de tratamiento a doble ciego se mantuvo durante 2 años adicionales de estudios de extensión abiertos.
Qmáx (flujo urinario máximo):
El Qmáx medio inicial para los estudios fue de aproximadamente 10 ml/seg (Qmáx normal ≥15 ml/seg). Después de uno y dos años de tratamiento el flujo en el grupo placebo había mejorado en 0,8 y 0,9 ml/seg, respectivamente, y 1,7 y 2,0 ml/seg, respectivamente, en el grupo de Avodart®. La diferencia entre los grupos fue estadísticamente significativa desde el Mes 1 al Mes 24. El aumento de la tasa máxima del flujo urinario visto durante los primeros 2 años de tratamiento a doble ciego se mantuvo durante 2 años adicionales de estudios de extensión abiertos.
Retención Urinaria Aguda e Intervención Quirúrgica
Después de dos años de tratamiento, la incidencia de RUA fue de 4,2% en el grupo placebo frente a 1,8% en el grupo de Avodart® (57% de reducción del riesgo). Esta diferencia es estadísticamente significativa e implica que 42 pacientes (IC 95%: 30-73) necesitaron ser tratados durante dos años para evitar un caso de RUA.
La incidencia de cirugía relacionada con HPB después de dos años fue de 4,1% en el grupo placebo y del 2,2% en el grupo de Avodart® (48% de reducción del riesgo). Esta diferencia es estadísticamente significativa e implica que 51 pacientes (IC 95%: 33-109) necesitaron ser tratados durante dos años para evitar una intervención quirúrgica.
Distribución del pelo
El efecto de dutasteride en la distribución del pelo no se estudió formalmente durante el programa de fase III, sin embargo, los inhibidores de la 5-α-reductasa pueden reducir la pérdida del cabello y pueden inducir el crecimiento del cabello en personas con patrón masculino de pérdida de cabello (alopecia androgenética masculina).
Función tiroidea
La función tiroidea se evaluó en un estudio de un año en hombres sanos. Los niveles de tiroxina libre se mantuvieron estables en el tratamiento con dutasteride pero los niveles de TSH aumentaron ligeramente (en 0,4 MCIU/ml) en comparación con el placebo al final de un año de tratamiento. Sin embargo, como los niveles de TSH fueron variables, la mediana de los rangos de TSH (1,4 a 1,9 MCIU/ml) se mantuvo dentro de límites normales (0,5 - 5/6 MCIU/ml), los niveles de tiroxina libre se mantuvieron estables dentro del rango normal y similar para ambos, el tratamiento con placebo y con dutasteride, los cambios en la TSH no se consideraron clínicamente significativos. En todos los estudios clínicos, no hubo evidencia de que dutasteride afecte negativamente a la función tiroidea.
Incidencia de cáncer mamario
En los estudios clínicos de 2 años de duración, donde 3.374 pacientes-año de exposición a dutasteride, y al momento del registro en la extensión abierta de 2 años, hubo dos casos de cáncer de mama reportados en los pacientes tratados con dutasteride y 1 caso en un paciente que recibió placebo. No hubo de cáncer de mama reportados en ninguno de los grupos de tratamiento en los estudios clínicos de 4 años CombAT y REDUCE en los cuales 17.489 pacientes-año se expusieron a dutasteride y 5.027 pacientes-año se expusieron a la combinación de dutasteride y tamsulosina.
Actualmente no es claro si hay una relación causal entre la ocurrencia de cáncer de mama en hombres y el uso prolongado de dutasteride.
Efectos sobre la fertilidad masculina
Los efectos de dutasteride 0,5 mg/día sobre las características del semen se evaluaron en voluntarios sanos con edades de 18 a 52 años (n=27 dutasteride, n=23 placebo) a lo largo de las 52 semanas de tratamiento y 24 semanas de seguimiento post-tratamiento. A las 52 semanas, la reducción media porcentual desde la condición inicial en el recuento espermático total, el volumen de semen y la motilidad espermática fueron de 23%, 26% y 18% respectivamente, en el grupo de dutasteride cuando se ajustó para los cambios desde la condición inicial en el grupo placebo. La concentración de espermatozoides y la morfología de los espermatozoides no se vieron afectadas. Después de 24 semanas de seguimiento, el cambio porcentual medio en el recuento espermático total en el grupo de dutasteride permaneció 23% por debajo de la condición inicial. Mientras que los valores medios para todos los parámetros en todos los puntos de tiempo permanecieron dentro de los rangos normales y no cumplieron los criterios predefinidos para un cambio clínicamente significativo (30%), dos sujetos en el grupo de dutasteride tuvieron disminuciones en el recuento de espermatozoides de más del 90% a partir de la condición inicial a las 52 semanas, con una recuperación parcial a las 24 semanas de seguimiento. No puede excluirse la posibilidad de fertilidad masculina reducida.
Insuficiencia cardíaca
En un estudio de HPB de 4 años de dutasteride en combinación con tamsulosina en 4.844 hombres (Estudio CombAT) la incidencia del criterio compuesto insuficiencia cardíaca en el grupo de combinación (14/1.610; 0,9%) fue mayor que en cualquiera de los grupos de monoterapia: dutasteride (4/1.623; 0,2%) y tamsulosina (10/1.611; 0,6%).
En un estudio separado de 4 años en 8.231 hombres de 50 a 75 años, con una biopsia previa negativa para cáncer de próstata y un nivel basal de PSA entre 2,5 ng/ml y 10,0 ng/ml en el caso de hombres de 50 a 60 años de edad, o 3 ng/ml y 10,0 ng/ml en el caso de hombres mayores de 60 años de edad (Estudio REDUCE), hubo una mayor incidencia del criterio compuesto insuficiencia cardíaca en sujetos que tomaron dutasteride 0,5 mg una vez al día (30/4.105; 0,7%) en comparación con sujetos que tomaron placebo (16/4.126; 0,4%). Un análisis post hoc de este estudio mostró una mayor incidencia del criterio compuesto insuficiencia cardíaca en los sujetos que tomaron dutasteride y un antagonista del adrenorreceptor alfa1 concomitantemente (12/1.152; 1,0%), en comparación con sujetos que tomaron dutasteride y ningún antagonista del adrenorreceptor alfa1 (18/2.953; 0,6%), placebo y un antagonista del adrenorreceptor alfa1 (1/1.399; <0,1%), o placebo y ningún antagonista del adrenorreceptor alfa1 (15/2.727; 0,6%).
Cáncer de próstata y tumores de alto grado
En una comparación de 4 años de placebo y dutasteride en 8.231 hombres entre 50 y 75 años de edad, con una biopsia previa negativa para cáncer de próstata y un nivel basal de PSA entre 2,5 ng/ml y 10,0 ng/ml en el caso de hombres entre 50 y 60 años de edad, o 3 ng/ml y 10,0 ng/ml en el caso de hombres mayores a 60 años de edad (Estudio REDUCE), se tuvieron datos de biopsia por punción prostática (principalmente establecidos por el protocolo) de 6.706 sujetos disponibles para determinar el Score de Gleason. En el estudio hubo 1.517 sujetos diagnosticados con cáncer de próstata. La mayoría de los cánceres de próstata detectables mediante biopsia en ambos grupos de tratamiento fueron diagnosticados como de grado bajo (Gleason 5-6, 70%).
Hubo una incidencia mayor de cáncer de próstata Gleason 8-10 en el grupo dutasteride (n=29, 0,9%) comparado con el grupo placebo (n=19, 0,6%) (p=0,15). En los años 1 y 2, el número de sujetos con cánceres Gleason 8-10 fue similar en el grupo dutasteride (n=17, 0,5%) y el grupo placebo (n=18, 0,5%). En los años 3 y 4, se diagnosticaron más cánceres Gleason 8-10 en el grupo dutasteride (n=12, 0,5%) comparado con el grupo placebo (n=1, <0,1%) (p=0,035). No se dispone de datos sobre el efecto de dutasteride luego de 4 años en hombres en riesgo de desarrollar cáncer de próstata. El porcentaje de sujetos diagnosticados con cánceres Gleason 8-10 fue consistente durante los períodos de tiempo del estudio (Años 1-2 y Años 3-4) en el grupo dutasteride (0,5% en cada período de tiempo), mientras que en el grupo placebo, el porcentaje de sujetos diagnosticados con cánceres Gleason 8-10 fue menor durante los Años 3-4 que en los Años 1-2 (<0,1% versus 0,5%, respectivamente) (Ver ADVERTENCIAS Y PRECAUCIONES). No hubo diferencia en la incidencia de cánceres Gleason 7-10 (p=0,81).
En un estudio de HPB de 4 años de duración (CombAT) donde no hubo biopsias mandatorias por protocolo y todos los diagnósticos de cáncer de próstata se basaron en biopsias por causa, las tasas de cánceres Gleason 8-10 fueron (n=8, 0,5%) para dutasteride, (n=11, 0,7%) para tamsulosina y (n=5, 0,3%) para el tratamiento en combinación.
La relación entre dutasteride y el cáncer de próstata de alto grado no es clara.
Tamsulosina
La tamsulosina aumenta la tasa máxima de flujo urinario. Alivia la obstrucción mediante la relajación del músculo liso en la próstata y la uretra, mejorando de esta forma los síntomas de vaciamiento. También mejora los síntomas de almacenamiento en los cuales desempeña un rol importante la inestabilidad de la vejiga. Estos efectos sobre los síntomas de almacenamiento y vaciamiento se mantienen durante la terapia a largo plazo. La necesidad de cirugía o cateterización se retrasa significativamente.
Los antagonistas de los receptores adrenérgicos A1 pueden reducir la presión arterial mediante la disminución de la resistencia periférica. No se observó reducción en la presión arterial de cualquier significancia clínica durante los estudios con tamsulosina.
DOSIS Y ADMINISTRACIÓN
POSOLOGÍA Y MODO DE ADMINISTRACIÓN:
Posología
Adultos (incluyendo ancianos)
La dosis recomendada de DUODART® es una cápsula (0,5 mg/0,4 mg) una vez al día. Cuando sea apropiado, DUODART® puede utilizarse para sustituir dutasteride y clorhidrato de tamsulosina concomitantes en una terapia dual existente para simplificar el tratamiento.
Cuando sea clínicamente apropiado, puede considerarse el cambio directo desde la monoterapia de dutasteride o clorhidrato de tamsulosina a DUODART®.
Insuficiencia renal
No se ha estudiado el efecto de la insuficiencia renal sobre la farmacocinética de dutasteride-tamsulosina.
No se prevé ajuste de la dosis para pacientes con insuficiencia renal (Ver ADVERTENCIAS Y PRECAUCIONES y PROPIEDADES FARMACOLÓGICAS – Propiedades Farmacocinéticas).
Insuficiencia hepática
No se ha estudiado el efecto de la insuficiencia hepática sobre la farmacocinética de dutasteride-tamsulosina, por lo que debe tenerse cuidado en pacientes con insuficiencia hepática leve a moderada (Ver ADVERTENCIAS Y PRECAUCIONES y PROPIEDADES FARMACOLÓGICAS – Propiedades Farmacocinéticas). En pacientes con insuficiencia hepática severa, el uso de DUODART® está contraindicado (Ver CONTRAINDICACIONES).
Población pediátrica
Dutasteride- tamsulosina está contraindicado en la población pediátrica (menos de 18 años) (ver CONTRAINDICACIONES).
Modo de administración
Para uso oral.
Los pacientes deben ser instruidos de tragar las cápsulas enteras, aproximadamente 30 minutos después de la misma comida cada día. Las cápsulas no deben ser masticadas o abiertas. El contacto con el contenido de la cápsula de dutasteride contenida dentro de la cápsula dura puede resultar en irritación de la mucosa bucofaríngea.
CONTRAINDICACIONES:
DUODART® está contraindicado en:
- Mujeres, niños y adolescentes (Ver Embarazo y Lactancia).
- Pacientes con hipersensibilidad a dutasteride, otros inhibidores de la 5-α-reductasa, tamsulosina (incluyendo angioedema inducido por tamsulosina), soja, maní o cualquiera de los excipientes mencionados en la sección FÓRMULA CUALI-CUANTITATIVA.
- Pacientes con antecedentes de hipotensión ortostática.
- Pacientes con insuficiencia hepática severa.
ADVERTENCIAS Y PRECAUCIONES:
DUODART® debe prescribirse tras una cuidadosa evaluación riesgo-beneficio debido al riesgo potencial incrementado de reacciones adversas (incluyendo insuficiencia cardíaca) y después de considerar las opciones de tratamiento alternativas, incluyendo monoterapias.
Insuficiencia cardíaca
En dos estudios clínicos de 4 años, la incidencia de insuficiencia cardíaca (un término compuesto de eventos reportados, principalmente insuficiencia cardíaca e insuficiencia cardíaca congestiva) fue mayor entre los sujetos que tomaron la combinación de dutasteride y un antagonista del adrenorreceptor alfa1, principalmente tamsulosina, de lo que fue entre los sujetos que no tomaban la combinación. En estos dos estudios, la incidencia de insuficiencia cardíaca fue baja (≤ 1%) y variable entre los estudios (Ver PROPIEDADES FARMACOLÓGICAS – Estudios Clínicos).
Efectos sobre el antígeno prostático específico (PSA) y detección de cáncer de próstata
El tacto rectal, así como otras evaluaciones para el cáncer de próstata u otras condiciones que pueden causar los mismos síntomas que la HPB, deben realizarse en los pacientes antes de iniciar el tratamiento con DUODART® y luego periódicamente.
La concentración sérica de antígeno prostático específico (PSA, por sus siglas en inglés) es un componente importante en la detección del cáncer prostático. DUODART® causa una disminución de aproximadamente un 50% en los niveles séricos medios de PSA, después de 6 meses de tratamiento.
Los pacientes tratados con DUODART® deben tener un nuevo nivel basal de PSA establecido luego de 6 meses de tratamiento con DUODART®. Se recomienda un monitoreo posterior regular de los niveles de PSA. Cualquier incremento confirmado de los niveles más bajos de PSA durante el tratamiento con DUODART® pueden indicar la presencia de cáncer de próstata (particularmente cáncer de alto grado) o un no cumplimiento con el tratamiento con DUODART®, y debe ser cuidadosamente evaluado, incluso si esos valores se encuentren aún en el rango normal para hombres no tratados con un inhibidor de la 5-α-reductasa (Ver PROPIEDADES FARMACOLÓGICAS – Estudios Clínicos). En la interpretación de un valor de PSA para un paciente tratado con DUODART®, para comparación deben usarse valores previos de PSA realizados durante el tratamiento con dutasteride.
El tratamiento con DUODART® no interfiere con el uso de PSA como una herramienta para asistir el diagnóstico del cáncer de próstata luego de que se establezca un nuevo nivel basal (Ver PROPIEDADES FARMACOLÓGICAS – Estudios Clínicos).
Los niveles de PSA sérico total regresan a los valores iniciales dentro de los 6 meses de la discontinuación del tratamiento. La relación entre PSA libre y total permanece constante incluso bajo la influencia de DUODART®. Si los médicos eligen usar porcentaje de PSA libre como ayuda en la detección del cáncer de próstata en los hombres sometidos a terapia con DUODART®, no parece ser necesario realizar el ajuste a este valor.
Cáncer de próstata y tumores de alto grado
Los resultados de un estudio clínico (Estudio REDUCE) en hombres con aumento del riesgo de cáncer de próstata revelaron una mayor incidencia de cáncer de próstata de clasificación Gleason 8-10 en los hombres tratados con dutasteride en comparación con placebo. La relación entre dutasteride y cáncer de próstata de alto grado no es clara.
Los hombres que toman DUODART deben ser evaluados en forma regular por riesgo de cáncer de próstata incluyendo una prueba de PSA (Ver PROPIEDADES FARMACOLÓGICAS - Estudios Clínicos).
Insuficiencia renal
El tratamiento de los pacientes con insuficiencia renal severa (clearance de creatinina inferior a 10 ml/min) debe enfocarse con precaución dado que estos pacientes no se han estudiado.
Hipotensión
Ortostática: Al igual que con otros antagonistas del adrenorreceptor alfa1 puede producirse una reducción de la presión arterial durante el tratamiento con tamsulosina, como resultado de lo cual, raramente, puede ocurrir síncope. Los pacientes que comienzan el tratamiento con DUODART® deben ser advertidos de sentarse o acostarse ante los primeros signos de hipotensión ortostática (mareos, debilidad) hasta que los síntomas se resuelvan.
Con el fin de minimizar el potencial desarrollo de una hipotensión postural el paciente debe ser hemodinámicamente estable en la terapia con antagonistas del adrenorreceptor alfa1 previo a iniciar el uso de inhibidores PDE5 (5-fosfodiesterasa).
Sintomática: Se recomienda precaución cuando agentes bloqueantes adrenérgicos alfa, incluyendo tamsulosina, se coadministren con inhibidores PDE5 (por ejemplo sildenafil, tadalafil, vardenafil). Los antagonistas del adrenorreceptor alfa1 y los inhibidores PDE5 son vasodilatadores que pueden disminuir la presión sanguínea. El uso concomitante de ambas clases de medicamentos puede potencialmente causar hipotensión sintomática (Ver Interacciones con otros medicamentos y otras formas de interacción).
Síndrome de Iris Fláccido Intraoperatorio
Se ha observado Síndrome de Iris Fláccido Intraoperatorio (IFIS, una variante del síndrome de pupila pequeña) durante cirugía de cataratas en algunos pacientes en tratamiento o previamente tratados con tamsulosina. El IFIS puede aumentar el riesgo complicaciones oculares durante y luego de la operación. Por lo tanto, no se recomienda el inicio de la terapia con DUODART® en pacientes para quienes se ha programado cirugía de cataratas.
Durante la evaluación pre-operatoria, los cirujanos de cataratas y los equipos de oftalmología deben considerar si los pacientes con cirugía de cataratas programada están siendo o han sido tratados con DUODART® a fin de garantizar que tengan lugar las medidas apropiadas para el manejo del IFIS durante la cirugía.
La interrupción de tamsulosina 1 a 2 semanas antes de la cirugía de cataratas es considerada útil en forma anecdótica, pero el beneficio y la duración de la interrupción del tratamiento antes de la cirugía de cataratas todavía no se han establecido.
Cápsulas con derrames
Dutasteride se absorbe a través de la piel, por lo tanto, las mujeres, los niños y los adolescentes deben evitar el contacto con derrames de las cápsulas (Ver Embarazo y Lactancia). Si se tiene contacto con derrames de cápsulas, el área de contacto debe lavarse inmediatamente con agua y jabón.
Inhibidores de CYP3A4 y CYP2D6
La administración concomitante de clorhidrato de tamsulosina con inhibidores potentes de CYP3A4 (por ejemplo ketoconazol), o en menor medida, con inhibidores potentes de CYP2D6 (por ejemplo paroxetina) puede aumentar la exposición a tamsulosina (Ver Interacción con otros medicamentos y otras formas de interacción). Por lo tanto, no se recomienda clorhidrato de tamsulosina en pacientes que toman inhibidores potentes de CYP3A4 y debe ser usado con precaución en pacientes que toman un inhibidor moderado de CYP3A4, un inhibidor potente o moderado de CYP2D6, una combinación de inhibidores CYP3A4 y CYP2D6, o en pacientes que se sabe son metabolizadores pobres de CYP2D6.
Insuficiencia hepática
No se ha estudiado DUODART® en pacientes con enfermedad hepática. Se debe tener precaución en la administración de DUODART® a los pacientes con insuficiencia hepática leve a moderada (Ver POSOLOGÍA Y MODO DE ADMINISTRACIÓN, CONTRAINDICACIONES y PROPIEDADES FARMACOLÓGICAS – Propiedades Farmacocinéticas).
Excipientes
Este medicamento contiene el colorante amarillo ocaso (E110), que puede causar reacciones alérgicas.
Neoplasia mamaria
Se ha reportado cáncer mamario en hombres tratados con dutasteride en estudios clínicos (Ver PROPIEDADES FARMACOLÓGICAS – Estudios Clínicos) y durante el período post-comercialización. Los médicos deben instruir a sus pacientes a reportar rápidamente cualquier cambio en su tejido mamario como un bulto o secreciones del pezón. Actualmente no es claro si hay una relación causal entre la ocurrencia del cáncer de mama en hombres y el uso prolongado de dutasteride.
Interacción con otros medicamentos y otras formas de interacción
No se han realizado estudios de interacción de fármacos para DUODART®. Las siguientes declaraciones reflejan la información disponible sobre los componentes individuales.
Dutasteride
Para obtener información sobre la disminución de los niveles séricos de PSA durante el tratamiento con dutasteride y orientación con respecto a la detección del cáncer de próstata, por favor ver ADVERTENCIAS Y PRECAUCIONES.
Efectos de otros fármacos sobre la farmacocinética de dutasteride
Dutasteride se elimina principalmente por metabolismo. Los estudios in vitro indican que este metabolismo es catalizado por CYP3A4 y CYP3A5. No se realizaron estudios formales de interacción con inhibidores potentes de CYP3A4. Sin embargo, en un estudio de farmacocinética poblacional, las concentraciones de dutasteride en suero fueron en promedio 1,6 a 1,8 veces mayor, respectivamente, en un pequeño número de pacientes tratados concomitantemente con verapamilo o diltiazem (inhibidores moderados del CYP3A4 e inhibidores de la glicoproteína P) que en otros pacientes.
La combinación a largo plazo de dutasteride con fármacos que son inhibidores potentes de la enzima CYP3A4 (por ejemplo, ritonavir, indinavir, nefazodona, itraconazol, ketoconazol administradas por vía oral) puede aumentar las concentraciones séricas de dutasteride. No es probable la inhibición adicional de la 5-α-reductasa en la exposición aumentada a dutasteride. Sin embargo, se puede considerar una reducción de la frecuencia de dosificación de dutasteride si se observan efectos secundarios. Cabe señalar que en el caso de inhibición enzimática, la vida media larga puede prolongarse adicionalmente y puede llevar más de seis meses de terapia concurrente antes de que se alcance un nuevo estado estacionario.
La administración de 12 g de colestiramina una hora antes de una dosis única de dutasteride de 5 mg no afectó a la farmacocinética de dutasteride.
Efectos de dutasteride sobre la farmacocinética de otros fármacos
En un pequeño estudio (n=24) de dos semanas de duración en hombres sanos, dutasteride (0,5 mg al día) no tuvo ningún efecto sobre la farmacocinética de tamsulosina o terazosina. Tampoco hubo ninguna indicación de una interacción farmacodinámica en este estudio.
Dutasteride no tuvo efecto sobre la farmacocinética de warfarina o digoxina. Esto indica que dutasteride no inhibe/induce el CYP2C9 o el transportador de la glicoproteína P. Estudios de interacción in vitro indican que dutasteride no inhibe las enzimas CYP1A2, CYP2D6, CYP2C9, CYP2C19 o CYP3A4.
Tamsulosina
La administración concomitante de clorhidrato de tamsulosina con fármacos que pueden reducir la presión arterial, incluyendo agentes anestésicos, inhibidores PDE5 y otros antagonistas de los adrenorreceptores alfa1 puede conducir a la intensificación de los efectos hipotensores. Dutasteride-tamsulosina no debe utilizarse en combinación con otros antagonistas de los adrenorreceptores alfa1.
La administración concomitante de clorhidrato de tamsulosina y ketoconazol (un potente inhibidor de CYP3A4) resultó en un incremento de Cmáx y ABC de clorhidrato de tamsulosina en un factor de 2,2 y 2,8 respectivamente. La administración concomitante de clorhidrato de tamsulosina y paroxetina (un potente inhibidor de CYP2D6) resultó en un incremento de Cmáx y ABC de clorhidrato de tamsulosina en un factor de 1,3 y 1,6 respectivamente. Un incremento similar es esperable en la exposición de metabolizadores leves de CYP2D6 en comparación con metabolizadores potentes cuando se coadministra con un inhibidor potente de CYP3A4. Los efectos de coadministración de ambos inhibidores de CYP3A4 y CYP2D6 con clorhidrato de tamsulosina no han sido evaluados clínicamente, sin embargo hay potencialmente un incremento significativo en la exposición a tamsulosina (Ver ADVERTENCIAS Y PRECAUCIONES).
La administración concomitante de clorhidrato de tamsulosina (0,4 mg) y cimetidina (400 mg cada seis horas durante seis días) dio como resultado una disminución en el clearance (26%) y un aumento en el ABC (44%) de clorhidrato de tamsulosina. Se debe tener precaución cuando dutasteride-tamsulosina se utiliza en combinación con cimetidina.
No se ha realizado un estudio definitivo de interacción fármaco-fármaco entre clorhidrato de tamsulosina y warfarina. Los resultados de los estudios limitados in vitro e in vivo no son concluyentes. Sin embargo, el diclofenac y la warfarina pueden aumentar la tasa de eliminación de tamsulosina. Debe tenerse precaución con la administración concomitante de warfarina y clorhidrato de tamsulosina.
No se observaron interacciones cuando se administró concomitantemente clorhidrato de tamsulosina con atenolol, enalapril, nifedipina o teofilina. La furosemida concomitante provoca una disminución de los niveles plasmáticos de tamsulosina, pero como los niveles permanecen dentro del rango normal no necesita ajustarse la posología.
In vitro, ni diazepam ni propranolol, triclormetiazida, clormadinon, amitriptilina, diclofenac, glibenclamida y simvastatina cambian la fracción libre de tamsulosina en el plasma humano. Tamsulosina tampoco cambia las fracciones libres de diazepam, propranolol, triclormetiazida y clormadinon.
Carcinogénesis, mutagénesis, alteración de la fertilidad
No se realizaron estudios no clínicos con DUODART®. Dutasteride y el clorhidrato de tamsulosina fueron evaluados ampliamente en pruebas de toxicidad en animales y los hallazgos fueron consistentes con las acciones farmacológicas conocidas de los inhibidores de la 5-α-reductasa y los antagonistas del adrenorreceptor alfa1. Las siguientes declaraciones reflejan la información disponible para los componentes individuales.
Dutasteride
Los estudios actuales de toxicidad general, genotoxicidad y carcinogenicidad no mostraron ningún riesgo particular para humanos.
Los estudios de toxicidad de la reproducción en ratas macho mostraron una disminución del peso de la próstata y de las vesículas seminales, disminución de la secreción de las glándulas genitales accesorias y reducción de los índices de fertilidad (provocados por el efecto farmacológico de dutasteride). Se desconoce la importancia clínica de estos hallazgos.
Como con otros inhibidores de la 5-α-reductasa, se observó feminización de fetos macho en ratas y conejos cuando se administró dutasteride durante la gestación. Se encontró dutasteride en sangre de ratas hembra después de aparearse con machos tratados con dutasteride. Cuando se administró dutasteride a primates durante la gestación, no se observó feminización de los fetos macho a exposiciones a sangre suficientemente superiores a las que probablemente ocurran a través del semen humano. Es improbable que un feto macho se vea negativamente afectado después de una transferencia seminal de dutasteride.
Tamsulosina
Los estudios de toxicidad general y genotoxicidad no mostraron ningún riesgo particular para humanos distinto a los relacionados con las propiedades farmacológicas de tamsulosina.
En estudios de carcinogenicidad en ratas y ratones, el clorhidrato de tamsulosina produjo un aumento de la incidencia de cambios proliferativos en la glándula mamaria en hembras. Estos hallazgos, los cuales probablemente están mediados por hiperprolactinemia y solamente ocurren a niveles de dosis altos, se consideran sin relevancia clínica.
Las dosis altas de clorhidrato de tamsulosina dieron como resultado una reducción reversible en la fertilidad de ratas macho considerada posiblemente debida a cambios en el contenido del semen o alteración en la eyaculación. No se evaluaron los efectos de tamsulosina sobre los recuentos de espermatozoides o la función espermática.
La administración de clorhidrato de tamsulosina a ratas y conejas preñadas a dosis mayores a la terapéutica no mostró evidencia de daño fetal.
Embarazo y Lactancia
DUODART® está contraindicado para el uso por mujeres. No se han realizado estudios para investigar el efecto de DUODART® sobre el embarazo, la lactancia y la fertilidad. Las siguientes declaraciones reflejan la información disponible de estudios con los componentes individuales (Ver Carcinogénesis, mutagénesis, alteración de la fertilidad).
Embarazo
Como con otros inhibidores de la 5-α-reductasa, dutasteride inhibe la conversión de testosterona a dihidrotestosterona y puede, si se administra a una mujer que lleva un feto masculino, inhibir el desarrollo de los genitales externos del feto (Ver ADVERTENCIAS Y PRECAUCIONES). Se han recuperado pequeñas cantidades de dutasteride del semen de sujetos que recibieron dutasteride. Se desconoce si un feto masculino se vea perjudicado si su madre está expuesta al semen de un paciente en tratamiento con dutasteride.
Como con todos los inhibidores de la 5-α-reductasa, cuando la pareja del paciente está o pudiera estar potencialmente embarazada, se recomienda que el paciente evite la exposición de su compañera al semen mediante el uso de un preservativo.
La administración de clorhidrato de tamsulosina a ratas y conejas preñadas no mostró evidencia de daño fetal.
Para información sobre datos preclínicos, ver Carcinogénesis, mutagénesis, alteración de la fertilidad.
Lactancia
No se conoce si dutasteride o tamsulosina se excretan en la leche materna humana.
Fertilidad
Se ha reportado que el dutasteride afecta las características del semen (reducción del recuento y motilidad de espermatozoides y el volumen del semen) en hombres sanos (ver Propiedades farmacodinámicas). No se puede excluir la posibilidad de reducción de la fertilidad masculina.
No se estudiaron los efectos de la tamsulosina clorhidrato sobre el recuento de espermatozoides y su funcionalidad.
Efectos sobre la capacidad para conducir y utilizar máquinas
No se han realizado estudios sobre los efectos de DUODART® sobre la capacidad para conducir y utilizar máquinas. Sin embargo, los pacientes deben ser informados de la posible ocurrencia de síntomas relacionados con la hipotensión ortostática, tales como mareo cuando toman DUODART®.
REACCIONES ADVERSAS:
Los datos presentados aquí se refieren a la co-administración de dutasteride y tamsulosina a partir del análisis a los 4 años del estudio CombAT (Combinación de Avodart® y Tamsulosina), una comparación de 0,5 mg de dutasteride y 0,4 mg de tamsulosina una vez al día durante cuatro años como co-administración o como monoterapia. Se ha demostrado la bioequivalencia de DUODART® con dutateride y tamsulosina co-administradas (Ver PROPIEDADES FARMACOLÓGICAS – Propiedades Farmacocinéticas). También se proporciona información sobre los perfiles de eventos adversos de los componentes individuales (dutasteride y tamsulosina). Tener en cuenta que no todos los eventos adversos reportados con los componentes individuales se han reportado con DUODART® y se han incluido para información del prescriptor.
Los datos a los 4 años del estudio CombAT han demostrado que la incidencia de cualquier evento adverso considerado por el investigador como relacionado con el fármaco durante el primer, segundo, tercer y cuarto año de tratamiento fue respectivamente del 22%, 6%, 4% y 2% para la terapia de co-administración de dutasteride + tamsulosina, del 15%, 6%, 3% y 2% para la monoterapia con dutasteride y un 13%, 5%, 2% y 2% para la monoterapia con tamsulosina. La mayor incidencia de eventos adversos en el grupo de terapia de co-administración en el primer año de tratamiento fue debido a una mayor incidencia de trastornos reproductivos, específicamente trastornos de la eyaculación, observada en este grupo.
Los eventos adversos considerados por el investigador como relacionados con el fármaco han sido informados con una incidencia mayor o igual al 1% durante el primer año de tratamiento en el Estudio CombAT, estudios clínicos de monoterapia HPB y estudio REDUCE se muestran en el cuadro siguiente.
Además, las reacciones adversas de tamsulosina a continuación se basan en información disponible de dominio público. Las frecuencias de los eventos adversos pueden aumentar cuando se utiliza la terapia de combinación.
Las frecuencias de las reacciones adversas identificadas en los estudios clínicos:
Comunes: ≥1/100 a <1/10, Poco comunes: ≥1/1.000 a <1/100, Raramente: ≥1/10.000 a <1/1.000, Muy raramente: <1/10.000. Dentro de cada agrupación de Clase de sistema orgánico, los eventos adversos se presentan en orden de gravedad decreciente.
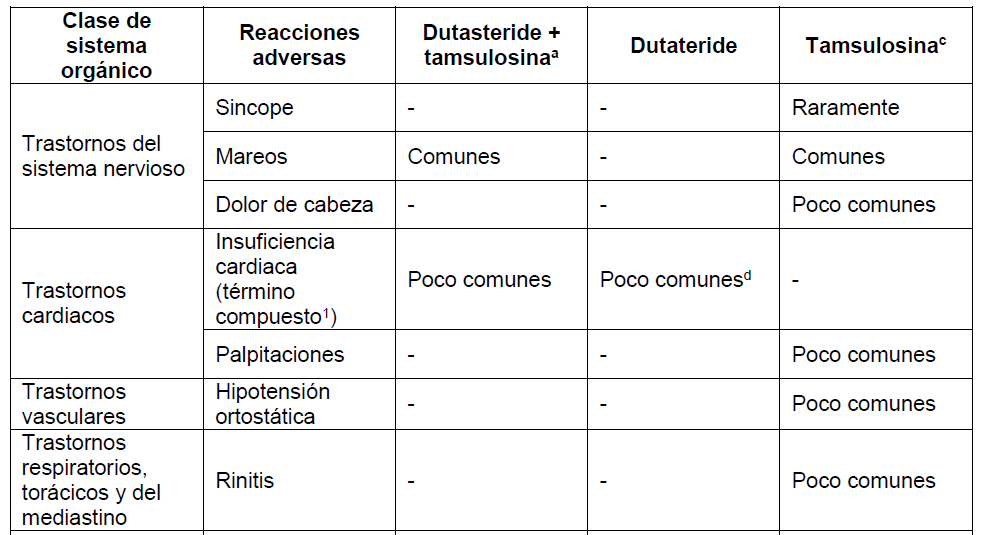
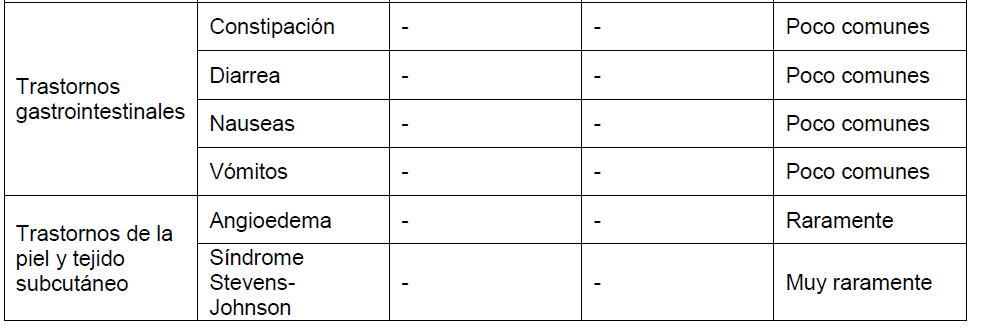
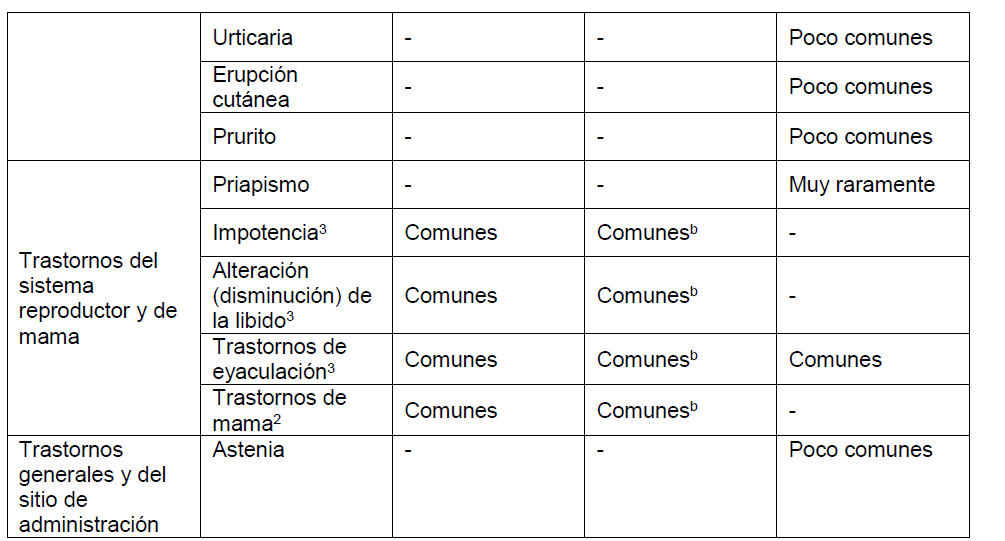
aDutasteride + tamsulosina: Del estudio CombAT – las frecuencias de estos eventos adversos decrecen durante el tiempo de tratamiento, del año 1 al año 4.
bDutasteride: De los estudios clínicos de monoterapia para HPB.
cTamsulosina: Del Perfil de Seguridad Básico de la UE para tamsulosina.
dEstudio REDUCE (Ver PROPIEDADES FARMACOLÓGICAS – Estudios Clínicos).
1Insuficiencia cardíaca es un término compuesto que reúne Insuficiencia cardíaca congestiva, insuficiencia cardíaca, insuficiencia ventricular izquierda, insuficiencia cardíaca aguda, shock cardiogénico, insuficiencia ventricular izquierda aguda, insuficiencia ventricular derecha, insuficiencia ventricular derecha aguda, insuficiencia ventricular, insuficiencia cardiopulmonar, cardiomiopatía congestiva.
2Incluye sensibilidad y aumento del tamaño de las mamas.
3Estos eventos adversos sexuales son asociados al tratamiento con dutasteride (incluyendo la monoterapia y la combinación con tamsulosina). Estos eventos adversos pueden persistir luego de la discontinuación del tratamiento. El rol de dutasteride en esta persistencia es desconocido.
OTRA INFORMACIÓN
El estudio REDUCE reveló una incidencia mayor de cáncer de próstata Gleason 8-10 en los hombres tratados con dutasteride comparado con placebo (ver PROPIEDADES FARMACOLÓGICAS – Estudios Clínicos y ADVERTENCIAS Y PRECAUCIONES). No se ha establecido si el efecto de dutasteride para reducir el volumen de la próstata, o factores relacionados al estudio, impactó en los resultados de este estudio.
Se ha reportado lo siguiente en estudios clínicos y en uso post-comercialización: Cáncer mamario en hombres (Ver ADVERTENCIAS Y PRECAUCIONES).
Datos post-comercialización
Los eventos adversos de la experiencia post-comercialización alrededor del mundo se han identificado de reportes post-comercialización espontáneos; por lo tanto se desconoce la incidencia real.
Dutasteride:
Trastornos del sistema inmune: Reacciones alérgicas, incluyendo erupción cutánea, prurito, urticaria, edema localizado, y angioedema.
Trastornos psiquiátricos: Depresión.
Trastornos de la piel y tejido subcutáneo: Alopecia (primariamente pérdida de pelo corporal), hipertricosis, poco frecuente.
Trastornos del sistema reproductivo y de la mama: Dolor e hinchazón testicular.
Tamsulosina:
Durante la vigilancia post-comercialización, surgieron reportes que asociaron el Síndrome de Iris Fláccido Intraoperatorio (IFIS), una variante del síndrome de pupila pequeña, durante la cirugía de cataratas con la terapia con antagonistas de los adrenorreceptores alfa1, incluyendo tamsulosina (Ver ADVERTENCIAS Y PRECAUCIONES).
Adicionalmente se han reportado fibrilación atrial, arritmia, taquicardia, disnea, epistaxis, visión borrosa, problemas visuales, eritema multiforme, dermatitis exfoliativa, desórdenes de la eyaculación, eyaculación retrógrada, fallas de la eyaculación y sequedad de boca en asociación con el uso de tamsulosina. La frecuencia de los eventos y el rol de tamsulosina en su causa no pueden determinarse con fiabilidad.
Reporte de sospecha de reacciones adversas
El reporte de reacciones adversas luego de la aprobación de una especialidad medicinal es importante. Esto permite el monitoreo del balance riesgo beneficio del medicamento.
SOBREDOSIFICACIÓN:
No hay datos disponibles con respecto a sobredosificación con DUODART®. Las siguientes declaraciones reflejan la información disponible sobre los componentes individuales.
Dutasteride
En estudios con voluntarios, dosis únicas diarias de dutasteride de hasta 40 mg/día (80 veces la dosis terapéutica) se administraron durante 7 días sin preocupaciones de seguridad significativas. En los estudios clínicos, se administraron dosis de 5 mg diarios a sujetos durante 6 meses sin efectos adversos adicionales a los observados con dosis terapéuticas de 0,5 mg. No hay antídoto específico para dutasteride, por lo tanto, en casos de sospecha de una sobredosificación debe darse tratamiento sintomático y de apoyo según el caso.
Tamsulosina
Se informó sobredosis aguda con 5 mg de clorhidrato de tamsulosina. Se observaron hipotensión aguda (presión arterial sistólica de 70 mm Hg), vómitos y diarrea los que fueron tratados con reposición de líquidos y el paciente pudo ser dado de alta el mismo día. En caso de hipotensión aguda que ocurre después de una sobredosificación debe darse apoyo cardiovascular. La presión arterial se puede restaurar y el ritmo cardíaco retornarse a la normalidad recostando al paciente. Si esto no ayuda pueden emplearse expansores de volumen y cuando sea necesario, vasoconstrictores. Debe controlarse la función renal y aplicarse medidas generales de apoyo. Es poco probable que la diálisis sea de ayuda dado que tamsulosina está muy altamente unida a las proteínas plasmáticas.
Pueden tomarse medidas tales como vómitos para impedir la absorción. Cuando se involucran grandes cantidades puede aplicarse lavado gástrico y puede administrarse carbón activado y un laxante osmótico, como el sulfato de sodio.
Ante la eventualidad de una sobredosificación, concurrir al hospital más cercano o comunicarse con los centros de toxicología: Hospital de Pediatría Ricardo Gutiérrez (011) 4962-6666/2247 o al Hospital A. Posadas (011) 4654-6648/4658-7777.





