嗜好性に関するデータ
エリプタを好むと答えた患者さんの割合は71%でした

目的
患者が認識するエリプタの課題を特定し、それらの課題が起こる状況を把握するとともに、患者の考える吸入器の特徴および他の吸入器と比べた患者の好みについて調査することを目的とした。
対象
レルベアまたはフルチカゾンフランカルボン酸エステル(FF)単剤の第III相試験を完了し、インタビューの承諾が得られた18歳以上の気管支喘息患者33例およびCOPD患者42例(うち、ディスカスの使用経験を有する気管支喘息患者21例)
方法
臨床試験を完了した4週間以内にインタビューを実施し、それまで使用していた吸入器と新たに使用したエリプタのどちらを好むかを定性調査で評価した。統計学的な推定は行わなかった。
調査項目
一般的な質問、吸入器の使用経験、疾患の重症度をフリーアンサー形式で質問し、エリプタについての患者の認識(使用の簡便性・保存・持ち歩きやすさ・それまで使用していた吸入器と新たに使用したエリプタの患者の好み)を1~10点のスケールを用いて評価した。
Svedsater H et al: BMC Pulm Med 2013;13, 72より作図
利益相反:本試験にかかわる費用は、グラクソ・スミスクライン(株)が負担した。
著者には、グラクソ・スミスクライン(株)の社員が含まれた。
ステップ数、時間、簡単さの点において、COPD患者の約60%がエリプタを好みました
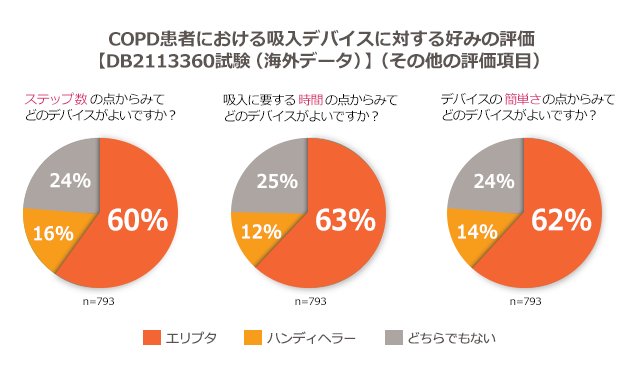
主要評価項目の結果
【第III相(DB2113360)試験:海外データ】
投与169日目のFEV1トラフ値(mL)(ITT集団)
| チオトロピウム群 (n=203) |
VI群 (n=205) |
アノーロ群 (n=207) |
|
|---|---|---|---|
| ベースラインからの変化量 LS mean(SE) |
121 (19) | 121 (19) | 211 (18) |
| アノーロ群に対する差 (95%CI) p値 |
90 (39, 141) p=0.0006 |
90 (39, 142) p=0.0006 |
ー |
解析は、治療群、ベースライン値(投与1日目の投与30分および5分前の2回のFEV1測定値の平均値)、喫煙状況、施設グループ、投与日、投与日とベースライン値の交互作用および投与日と治療群の交互作用を共変量とした反復測定モデルを用いて行った。
安全性【第III相(DB2113360)試験:海外データ】
治療期間中及び後観察期間中に試験薬と関連があると判断された有害事象の発現率は、アノーロ群5%(11/212例)、VI群6%(12/209例)、チオトロピウム群3%(7/208例)であった。
試験薬と関連があると判断された主な有害事象(いずれかの治療群で発現割合が1%以上)は、口内乾燥[アノーロ群<1%(1/212例)、VI群0%(0/209例)、チオトロピウム群1%(3/208例)]であった。
治療期間中および後解析期間中に試験薬と関連があると判断された重篤な有害事象は、VI群の3例にみられた上室性期外収縮、急性心筋梗塞、慢性閉塞性肺疾患(各1例)であった。
治療期間中および後解析期間中に試験中止または試験薬投与中止に至った有害事象の発現率は、アノーロ群5%(10/212例)、VI群5%(10/209例)、チオトロピウム群4%(9/208例)であった。いずれかの治療群において1%以上みられた有害事象は慢性閉塞性肺疾患のみであった。
本試験期間中に、VI群の1例が急性心不全により、アノーロ群の1例が慢性閉塞性肺疾患(医師報告事象名:COPDの増悪)および心停止により死亡した。いずれの死亡も試験薬との関連はないと判断された。
目的
COPD患者にウメクリジニウム(UMEC)/ビランテロール(VI)の2用量を24週間投与したときの有効性および安全性をVIおよびチオトロピウムと比較検討する。
対象
10pack-years以上の喫煙歴があり、サルブタモール吸入後の1秒量(FEV1)/努力性肺活量(FVC)比が0.70未満で40歳以上のCOPD患者843例
方法
多施設共同・無作為化・二重盲検・ダブルダミー・並行群間比較試験。UMEC/VI 125/25μg(UMEC/VI 125/25μg群)、UMEC/VI 62.5/25μg(アノーロ群)、VI 25μg(VI群)またはプラセボをエリプタを用いて、チオトロピウム18μg(チオトロピウム群) またはプラセボをハンディヘラーを用いて、1日1回24週間朝に吸入投与した。
評価項目
[ 有効性評価項目 ]
主要評価項目:
投与169日目のトラフFEV1値(気管支拡張薬投与前)
副次評価項目:
投与24週目の投与後0~6時間のFEV1加重平均値
その他の評価項目:
吸入器についての評価等
[ 安全性評価項目 ]
有害事象の発現頻度、血液生化学的検査および血液学的検査、バイタルサイン、12誘導心電図
[ ヘルスアウトカムズ ]
St.George's Respiratory Questionnaire(SGRQ)、EuroQol Questionnaire(EQ-5D)、COPDアセスメントテスト(CAT)
解析計画
投与169日目のトラフFEV1値は、ITT集団を対象に、反復測定混合モデルを用いて解析を行うこととした。吸入器についての被験者評価は、質問票の結果を記録した。
[ アノーロ承認時評価資料 ]
[ Decramer M et al: Lancet Respir Med 2014; 2(6), 472-486 ]*
*利益相反:本試験に関わる費用は、GSKの支援を受けた。著者には、GSKが過去に研究助成金・会議参加費・講演料・コンサルティング費を支払った者、GSKの社員・株主・自社株購入権を有する者が含まれる。
| アノーロの 用法・用量 |
通常、成人にはアノーロエリプタ1吸入(ウメクリジニウムとして62.5μg及びビランテロールとして25μg)を1日1回吸入投与する。 |
|---|
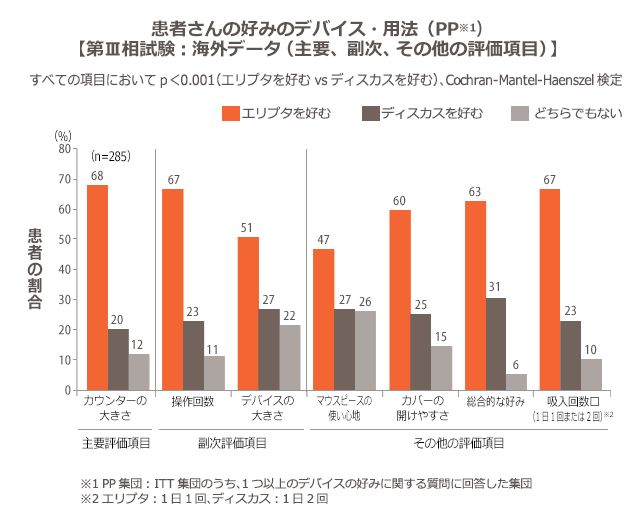
エリプタは、ディスカスより患者さんに好まれました
安全性【第III相試験:海外データ】
有害事象の発現頻度は、エリプタ使用8%(23/287例)、ディスカス使用5%(14/285例)であった。主な有害事象(いずれかのデバイスで3例以上の発現)は、頭痛(エリプタ使用2例、ディスカス使用5例)、背部痛(エリプタ使用3例、ディスカス使用0例)であった。
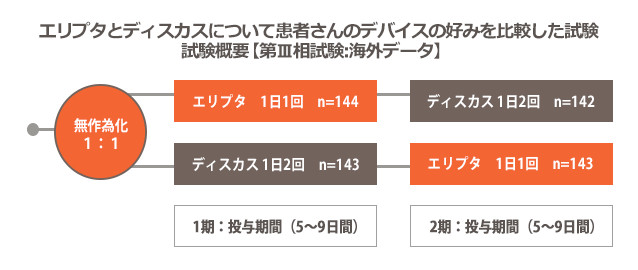
目的
COPD患者がエリプタとディスカスをそれぞれ約1週間使用した後にどちらのデバイスを好むかを評価した。
対象
喫煙歴があり、サルブタモール吸入後の1秒量(FEV1)/努力性肺活量(FVC)比が0.70以下、かつFEV1が予測値の70%以下である、40歳以上のCOPD患者287例
方法
多施設共同・無作為化・非盲検・並行群間比較試験。患者を1:1に無作為に割付け、エリプタを1日1回、または、ディスカスを1日2回用いて、プラセボを吸入投与した(1期)。2期では、1期とは別のデバイスに患者を割付けた。投与期間はいずれも5~9日間とした。試験終了後に、7項目からなるデバイスの好みに関する質問を行い、エリプタとディスカスのどちらを好むかについて調査した。
評価項目
[ 有効性評価項目 ]
主要評価項目:
好みのカウンターの大きさ
副次評価項目:
好みの操作回数、好みのデバイスの大きさ
その他の評価項目:
マウスピースの使い心地、カバーの開けやすさ、総合的な好み、吸入回数
[ 安全性評価項目 ]
有害事象等
解析計画
有効性評価項目は、ITT集団及びPP集団(ITT集団のうち、1つ以上のデバイスの好みに関する質問に回答した集団)を対象にCochran-Mantel-Haenszel検定を用いて解析した。
Yun Kirby S et al: COPD 2016; 13(2), 167-175
利益相反:本試験にかかわる費用は、グラクソ・スミスクライン(株)が負担した。
著者には、グラクソ・スミスクライン(株)の社員が含まれた。
製品名はすべて、グラクソ・スミスクライン、そのライセンサー、提携パートナーの登録商標です。
製剤写真及びPDF資料は、患者指導の目的に限りダウンロード頂けます。


