

MÉNĚ NEŽ
15%
míra přerušení léčby s přípravkem ZEJULA*1

NÍZKÁ MÍRA NÚ V PRŮBĚHU
4 let
léčby3

U MÉNĚ NEŽ
3%
pacientek léčených přípravkem ZEJULA se vyskytla trombocytopenie ≥ 3. stupně po 3 měsících léčby3
*Nejdelší následné sledování (follow up) v době uzavření této databáze bylo 24 měsíců.1
Nejčastější NÚ u ≥ 10 % pacientek léčených přípravkem ZEJULA†1
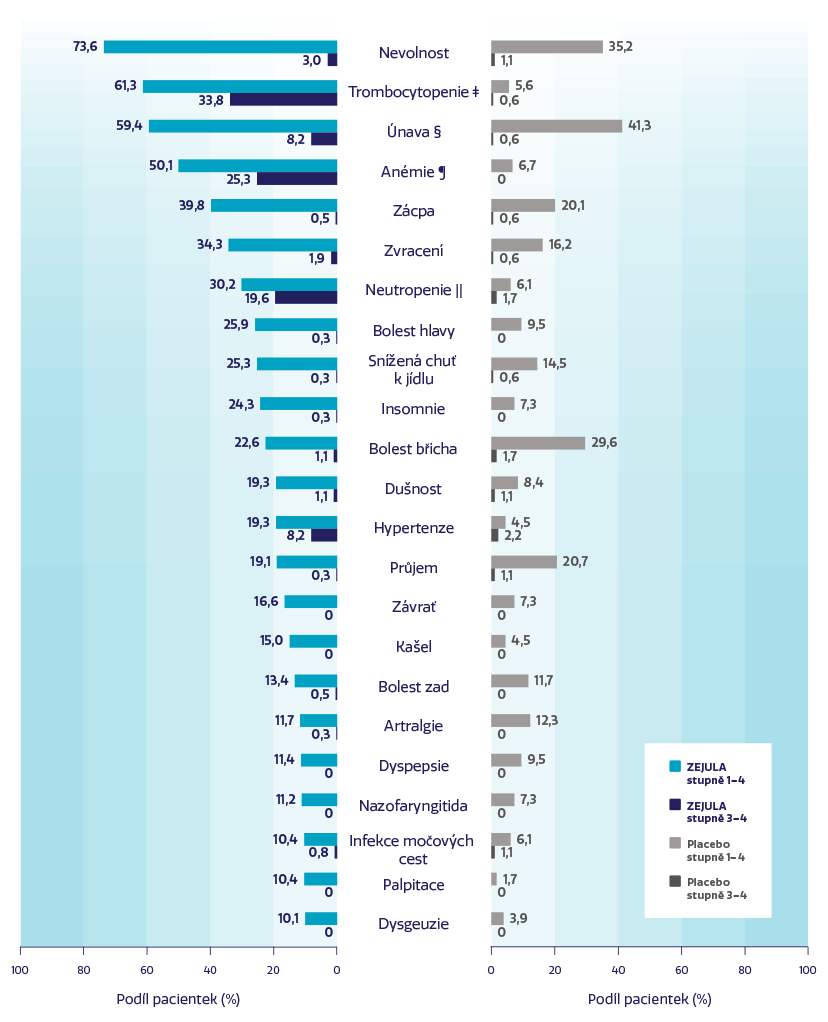
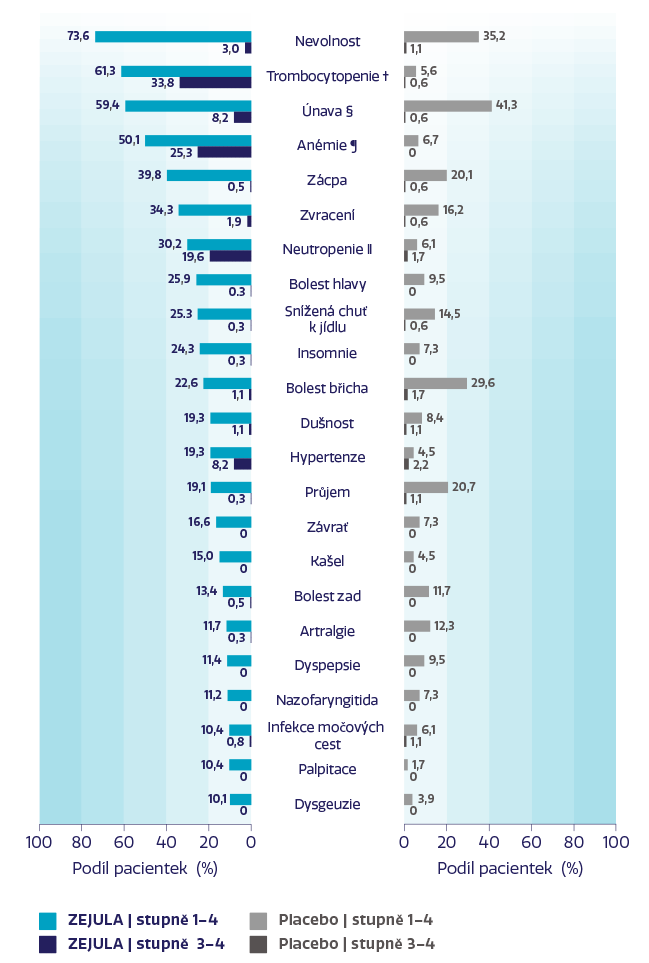
Nejběžnějšími závažnými NÚ byly trombocytopenie a anémie.2
† Jsou představena data všech pacientek u kterých se hodnotila bezpečnost (n = 546).1
‡ Zahrnuje hlášení o trombocytopenii a sníženém počtu trombocytů.1
§ Zahrnuje hlášení o únavě, astenii, malátnosti a letargii.1
¶ Zahrnuje hlášení o anémii a sníženém množství hemoglobinu.1
|| Zahrnuje hlášení o neutropenii a sníženém počtu neutrofilů.1

Pouze 14,7 % pacientek přerušilo léčbu přípravkem ZEJULA oproti 2,2 % s placebem.#1
# Nejdelší následné sledování (follow up) v době uzavření této databáze bylo 24 měsíců.1
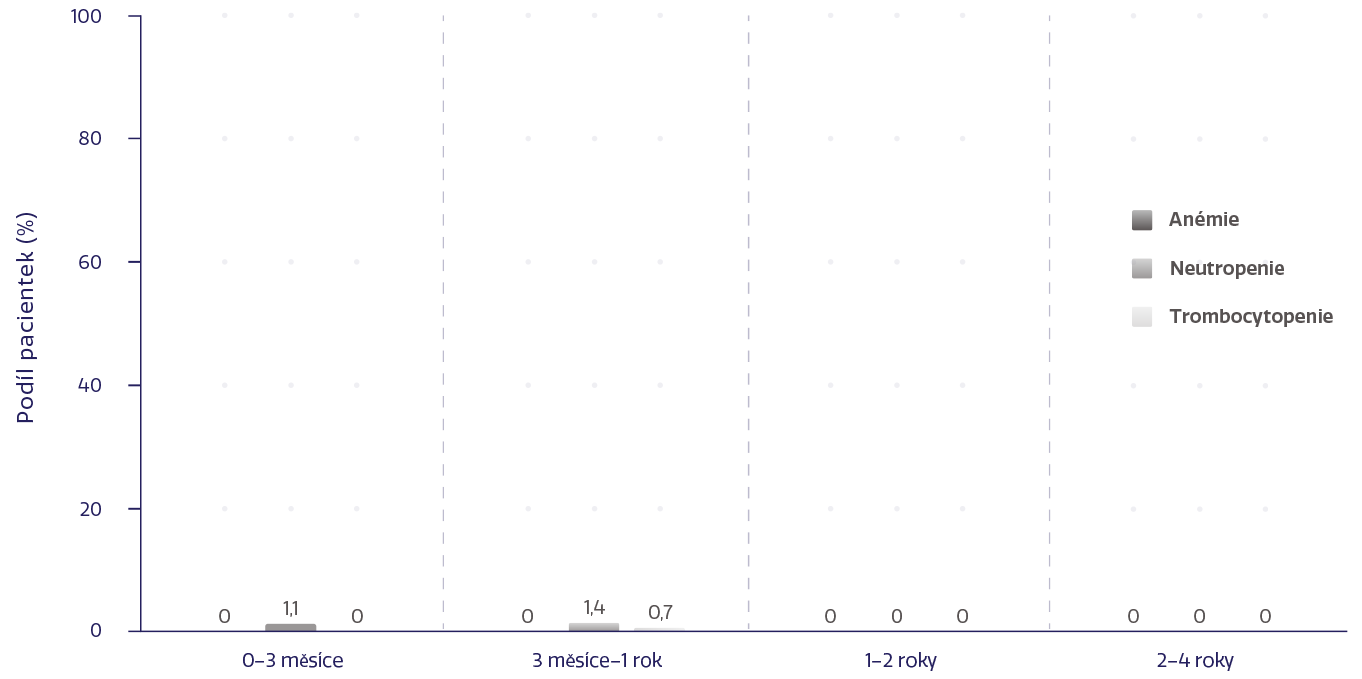
Hematologické NÚ ≥ 3. stupně podle délky expozice přípravku ZEJULA3
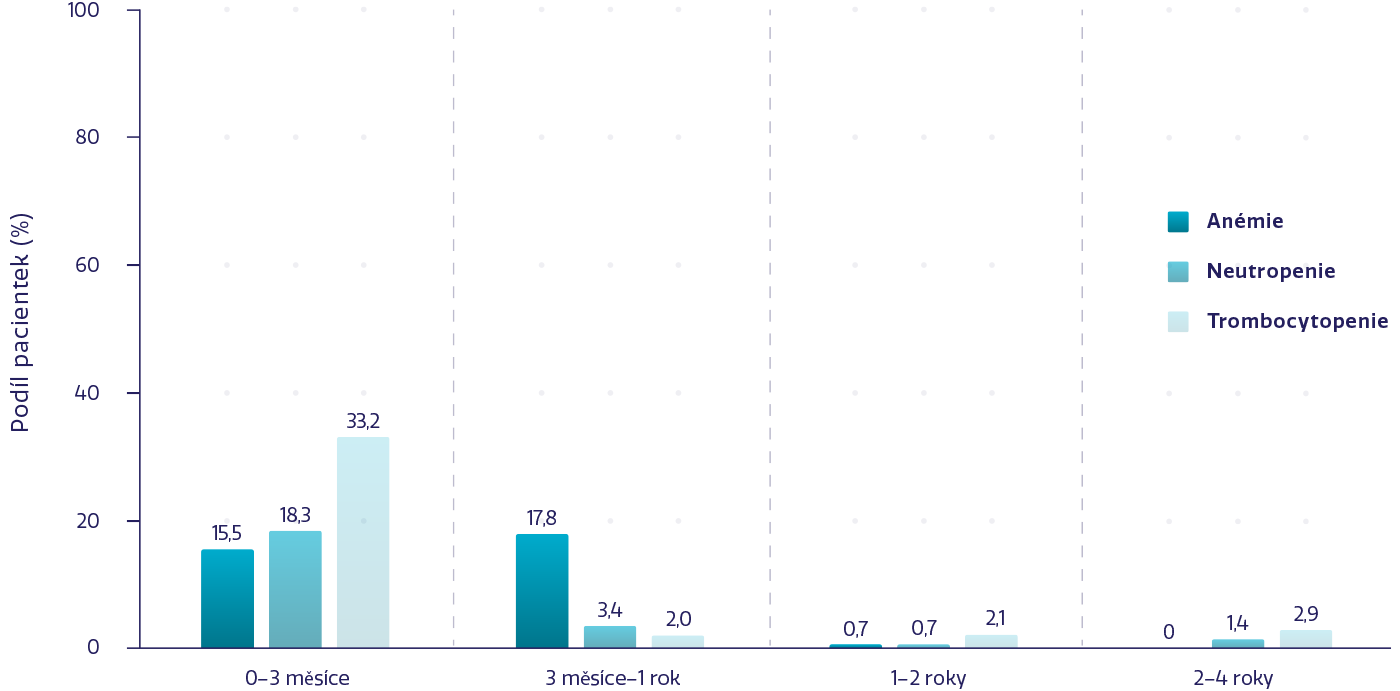
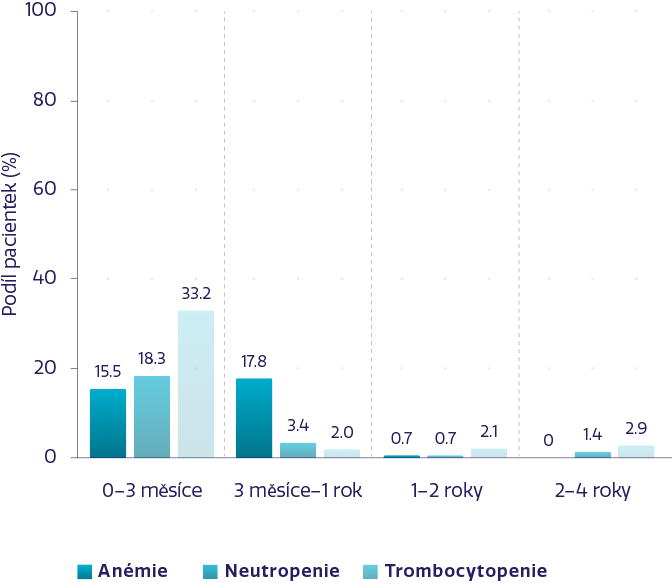
Z počátečních 367 pacientek ve skupině léčené přípravkem ZEJULA a 179 pacientek ve skupině, které bylo podáváno placebo, bylo 18,8 % a 5,6 % pacientek zařazeno do období hodnocení od 2 do 4 let.3

Většina NÚ byla vyřešena úpravou dávky během prvních 3 měsíců, což vedlo k jejich nízké incidenci po dobu 4 let.3
Hematologické AE ≥ 3. stupně podle délky expozice placebu3
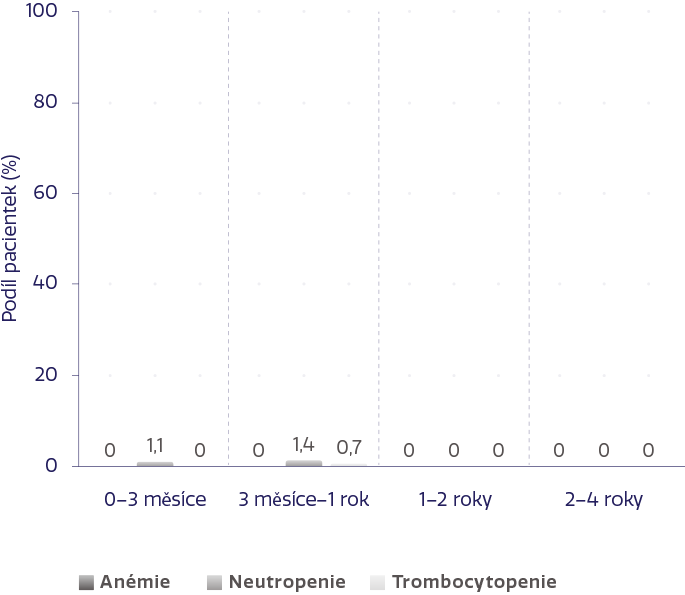
Z počátečních 367 pacientek ve skupině léčené přípravkem ZEJULA a 179 pacientek ve skupině, které bylo podáváno placebo, bylo 18,8 % a 5,6 % pacientek zařazeno do období hodnocení mezi 2. a 4. rokem.3

Většina NÚ byla vyřešena úpravou dávky během prvních 3 měsíců, což vedlo k jejich nízké incidenci po dobu 4 let.3

Zkratky
AE, nežádoucí příhoda.
Reference
- Mirza MR, Monk BJ, Herrstedt J, et al. N Engl J Med. 2016;375(22):2154-2164.
- SPC Zejula (niraparib), Souhrn údajů o přípravku Zejula, datum revize textu 05/2023
- Juden LM, Freese E, Bessette P, et al. Long-term safety of niraparib in patients with recurrent ovarian cancer: results from the ENGOT-OV16/NOVA trial. Poster presented at Oncology Nursing Society 44th Annual Congress; Anaheim, CA, USA, 11-14 April 2019.
ZEJULA je registrovaný léčívý přípravek, jehož výdej je vázán na lékařský předpis a je hrazen z prostředků veřejného zdravotního pojištění v indikaci 1. linie udržovací léčby. Léčivý přípravek podléhá dalšímu sledování. Případná podezření na nežádoucí účinky nám prosím hlaste na cz.safety@gsk.com. Před předepsáním léku se, prosím, seznamte s úplnou informací o přípravku, kterou najdete v Souhrnu údajů o přípravku na www.gskkompendium.cz nebo se obraťte na společnost GlaxoSmithKline, s.r.o., Hvězdova 1734/2c, 140 00 Praha 4; e-mail: cz.info@gsk.com; www.gsk.cz.
© 2023 Skupina společností GSK nebo držitel licence.
Všechny uvedené ochranné známky jsou majetkem jejich příslušných vlastníků.
Schváleno: 09/2023; PM-CZ-NRP-WCNT-210001





