- Ve studii NOVA bylo po úpravě nejčastěji podávanou dávkou 200 mg/den4
- Potřebu úpravy dávky mohou pomoci předpovědět dva základní faktory: tělesná hmotnost a počet trombocytů†4
- U pacientek s tělesnou hmotností < 58 kg lze zvážit zahajovací dávku 200 mg/den.‡1

Jednou denně
podávaná perorální dávka, kterou lze užívat kdykoli během dne, s jídlem nebo nalačno1
V PRŮBĚHU PRVNÍCH
3 měsíců
byla vyřešena většina NÚ úpravou dávky2
Jednoduchá úprava dávky ke zvládnutí vedlejších účinků díky 100mg tobolkám1

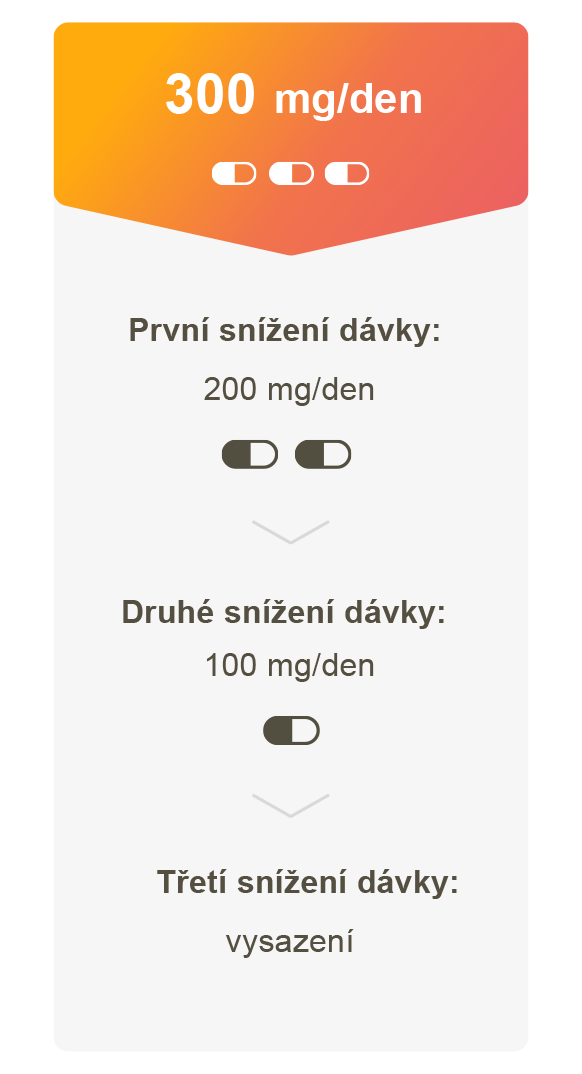
* Doporučená zahajovací dávka přípravku ZEJULA v udržovací léčbě druhé linie je 300 mg jednou denně.1
† Doporučuje se jednou týdně po dobu prvního měsíce testovat kompletní krevní obraz, poté jednou za měsíc po dobu následujících 10 měsíců léčby a po této době se doporučuje během léčby pravidelně sledovat klinicky významné změny v jakémkoli hematologickém parametru.1
‡ Přibližně 25 % pacientek ve studii NOVA vážilo méně než 58 kg.1
Sledování pomůže rozpoznat potřebu úpravy dávky1
Upravitelné dávkování, které nesnižuje účinnost3,4
Odhad PFS podle úrovně dávky měřené po 3. cyklu u všech pacientek¶3
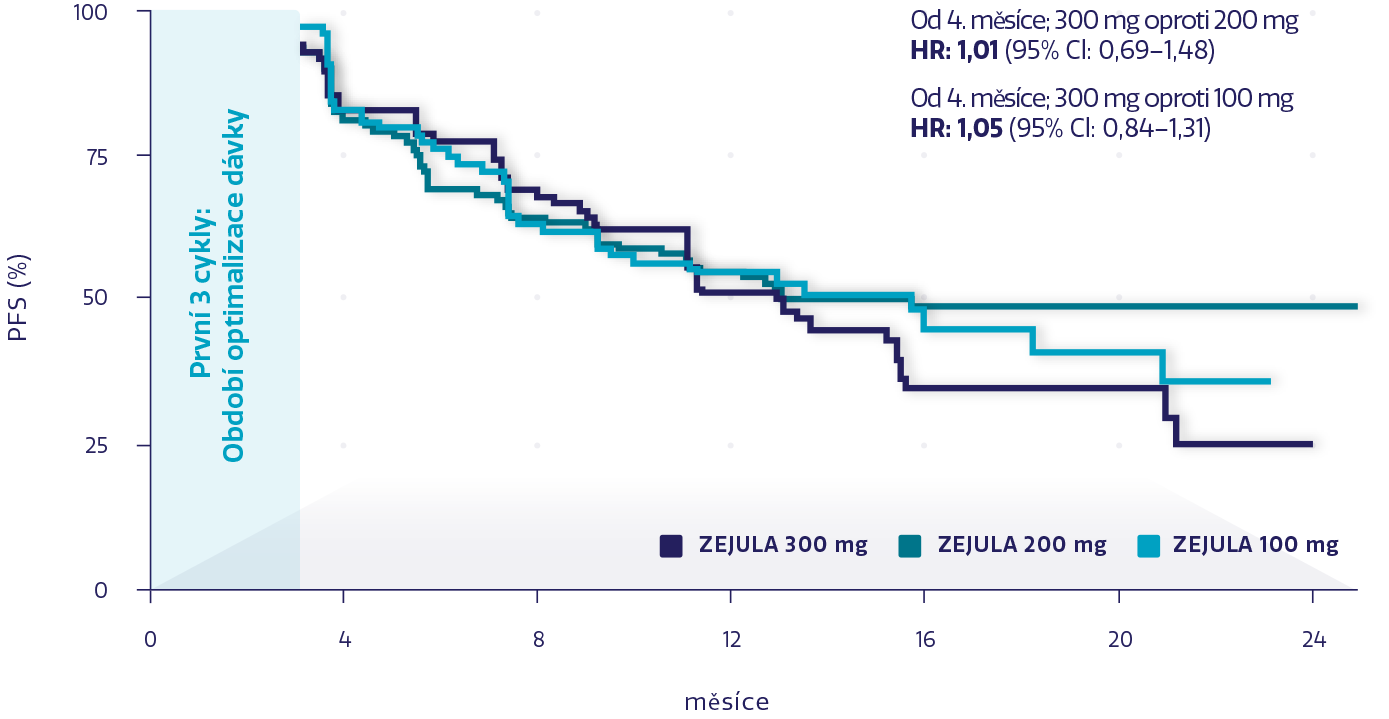
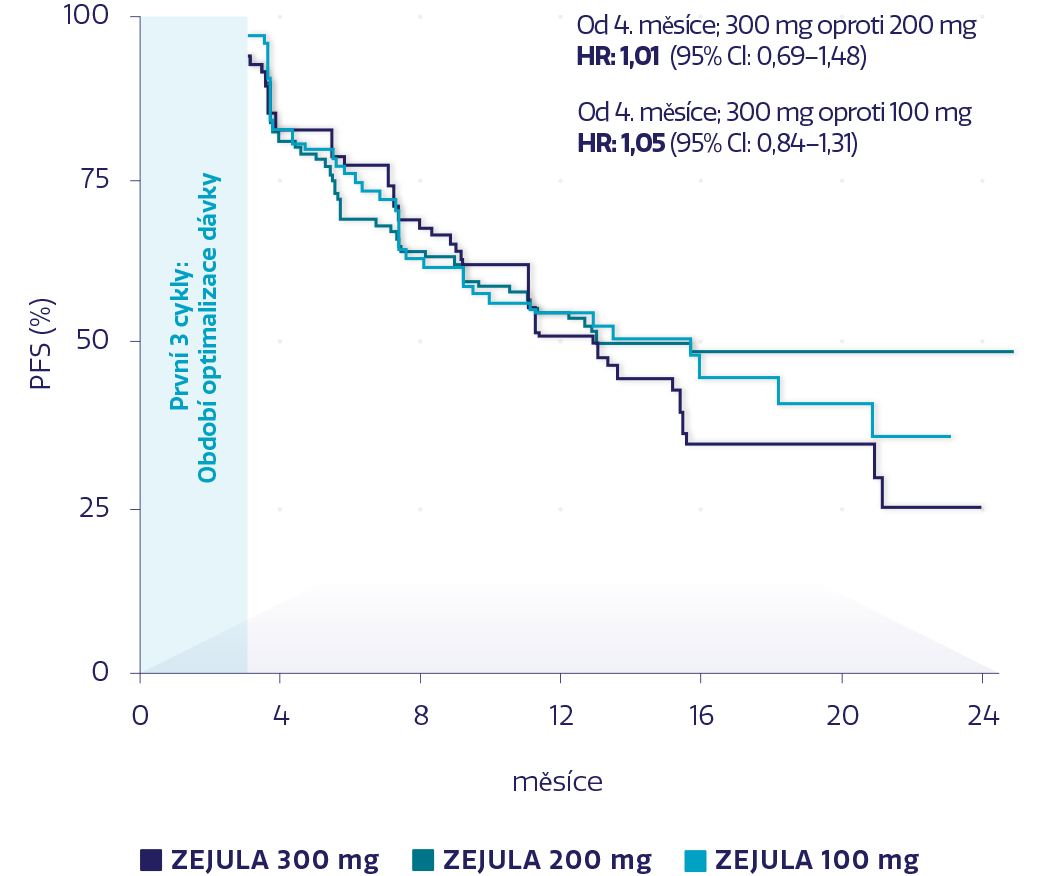
Obrázek převzat z Lord L, et al. 2018.3
Snížení dávky bylo třeba u pacientek se specifickými hematologickými a nehematologickými NÚ.¶4
¶ Výzkumná post-hoc analýza.
PFS po 3. cyklu bylo srovnatelné u pacientek, které dostávaly dávky 100 mg, 200 mg a 300 mg přípravku ZEJULA.3,4

Zkratky
NÚ, nežádoucí účinek; CI, interval spolehlivosti; HR, poměr rizik; PFS, přežití bez progrese.
Reference
- SPC Zejula (niraparib), Souhrn údajů o přípravku Zejula, datum revize textu 05/2023
- Juden LM, Freese E, Bessette P, et al. Long-term safety of niraparib in patients with recurrent ovarian cancer: results from the ENGOT-OV16/NOVA trial. Poster presented at Oncology Nursing Society 44th Annual Congress; Anaheim, CA, USA, 11-14 April 2019.
- Lord L, Mirza MR, Woelber L, et al. Safety and dose modification for patients with low body weight receiving niraparib in the ENGOT-OV16/NOVA phase 3 trial. Presented at the Society of Gynaecologic Oncology (SGO) 2018; New Orleans, LA, USA, 24-27 March 2018. Scientific Plenary 20.
- Berek JS, Matulonis UA, Peen U, et al. Ann Oncol. 2018;29(8):1784-1792.
ZEJULA je registrovaný léčívý přípravek, jehož výdej je vázán na lékařský předpis a je hrazen z prostředků veřejného zdravotního pojištění v indikaci 1. linie udržovací léčby. Léčivý přípravek podléhá dalšímu sledování. Případná podezření na nežádoucí účinky nám prosím hlaste na cz.safety@gsk.com. Před předepsáním léku se, prosím, seznamte s úplnou informací o přípravku, kterou najdete v Souhrnu údajů o přípravku na www.gskkompendium.cz nebo se obraťte na společnost GlaxoSmithKline, s.r.o., Hvězdova 1734/2c, 140 00 Praha 4; e-mail: cz.info@gsk.com; www.gsk.cz.
© 2023 Skupina společností GSK nebo držitel licence.
Všechny uvedené ochranné známky jsou majetkem jejich příslušných vlastníků.
Schváleno: 09/2023; PM-CZ-NRP-WCNT-210001









