

TÉMĚŘ
4x delší
medián PFS u pacientek s gBRCAm2

VÍCE NEŽ
2x delší
medián PFS u pacientek s non-gBRCAm2

76%
SNÍŽENÍ RIZIKA
u pacientek s gBRCAm a částečnou odpovědí na chemoterapii*3
Významně delší doba bez progrese bez ohledu na stav BRCA2
Téměř 4× delší medián PFS u pacientek s gBRCAm2
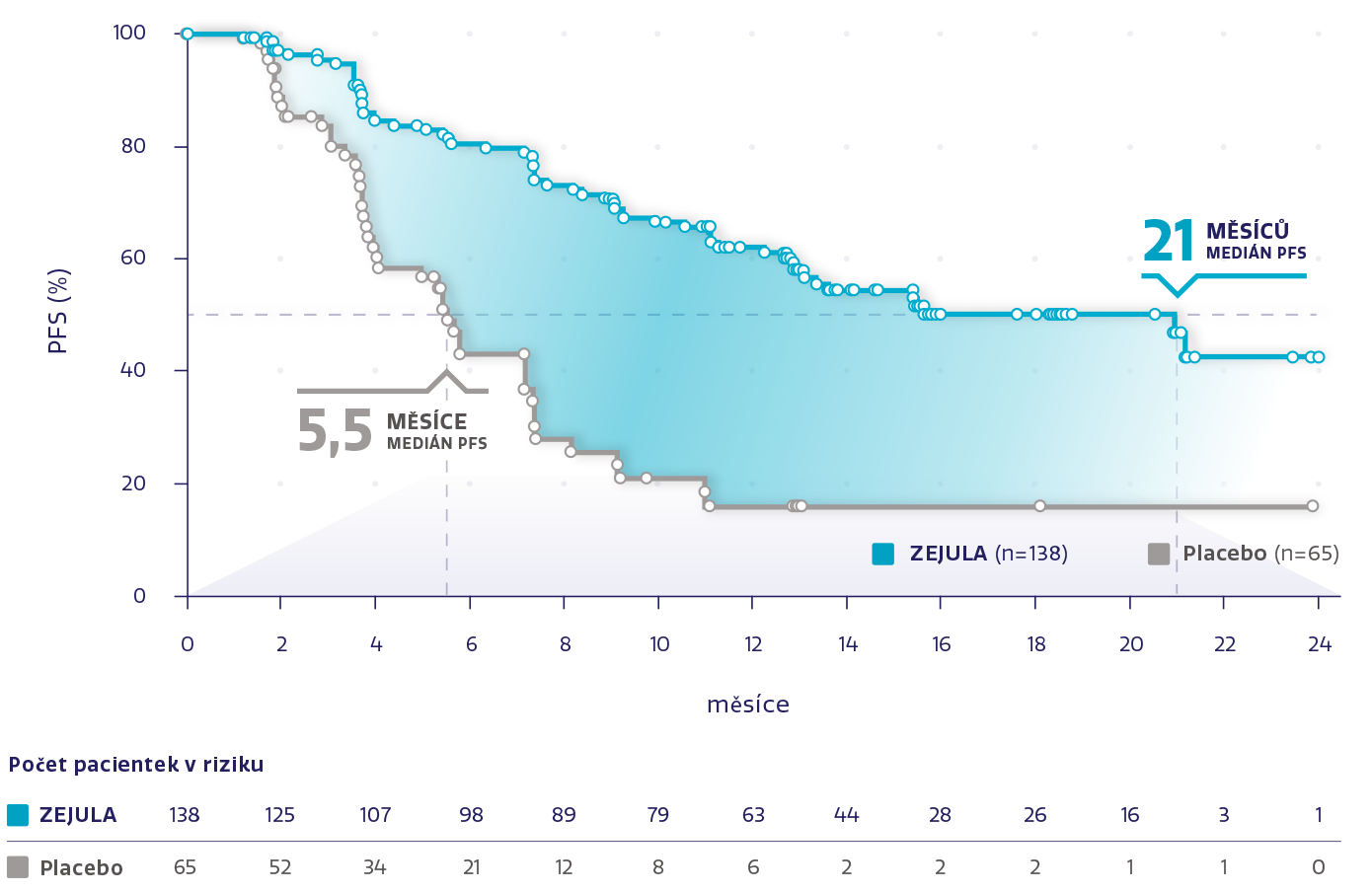
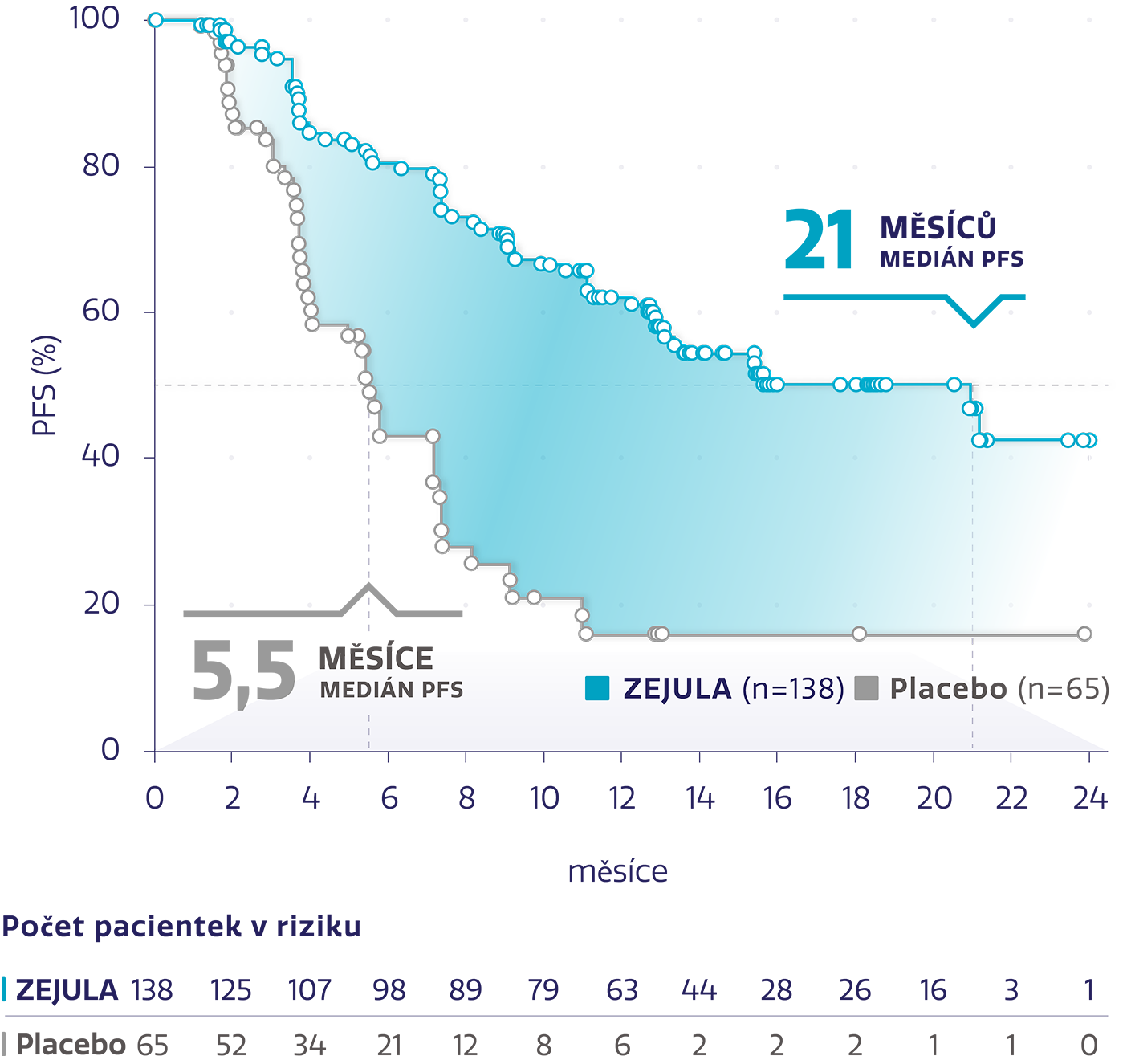
Obrázek převzat z Mirza MR, et al. 2016.2

snížení rizika progrese onemocnění nebo úmrtí oproti placebu2
HR: 0,27 (95% CI: 0,17-0,41), P < 0,001

Odhad přežití bez progrese ve 24 měsících stanoven na ~4 z 10
(42 % s přípravkem ZEJULA oproti 16 % s placebem)4
Více než 2× delší medián PFS u pacientek s non-gBRCAm2
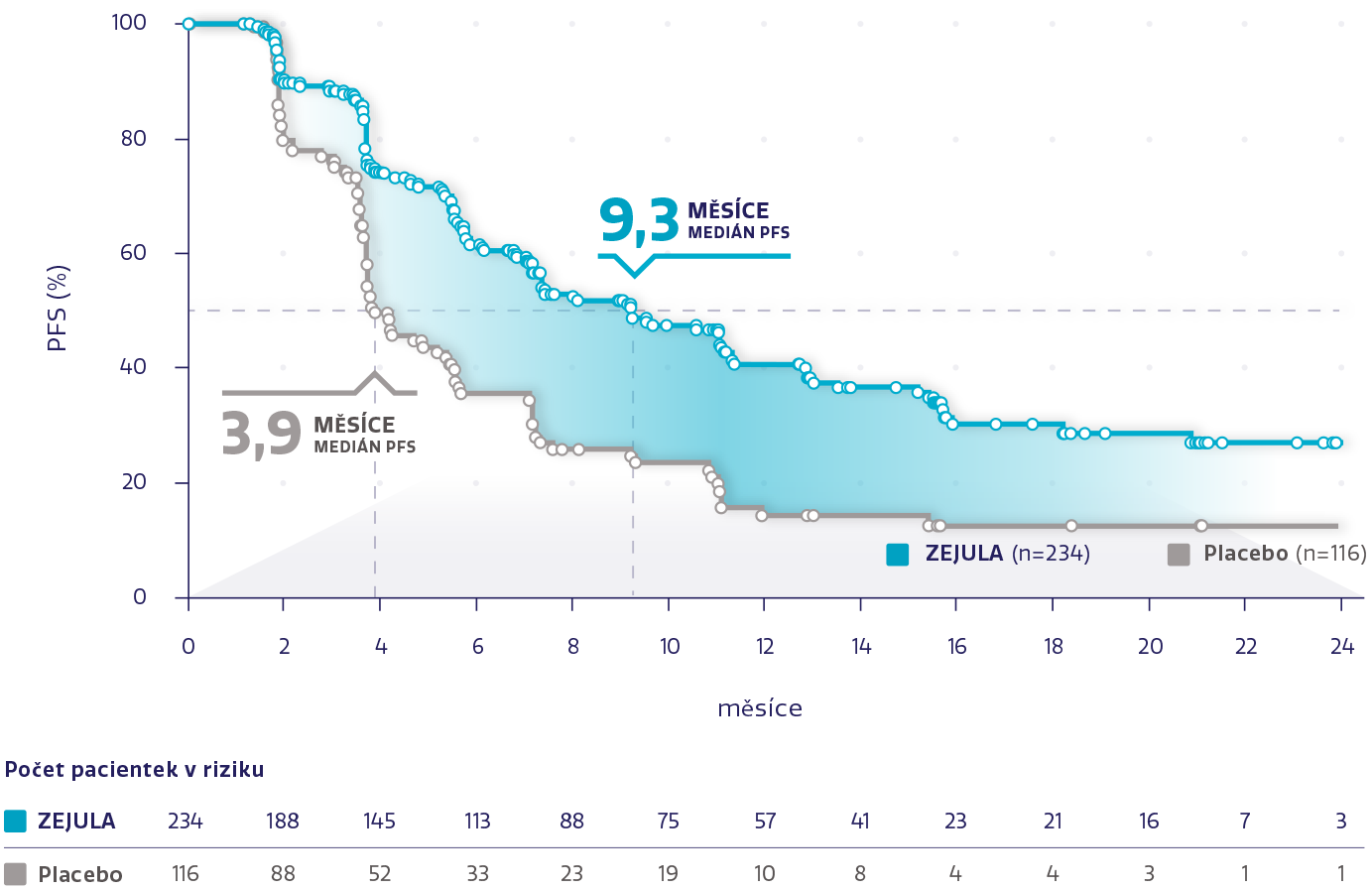
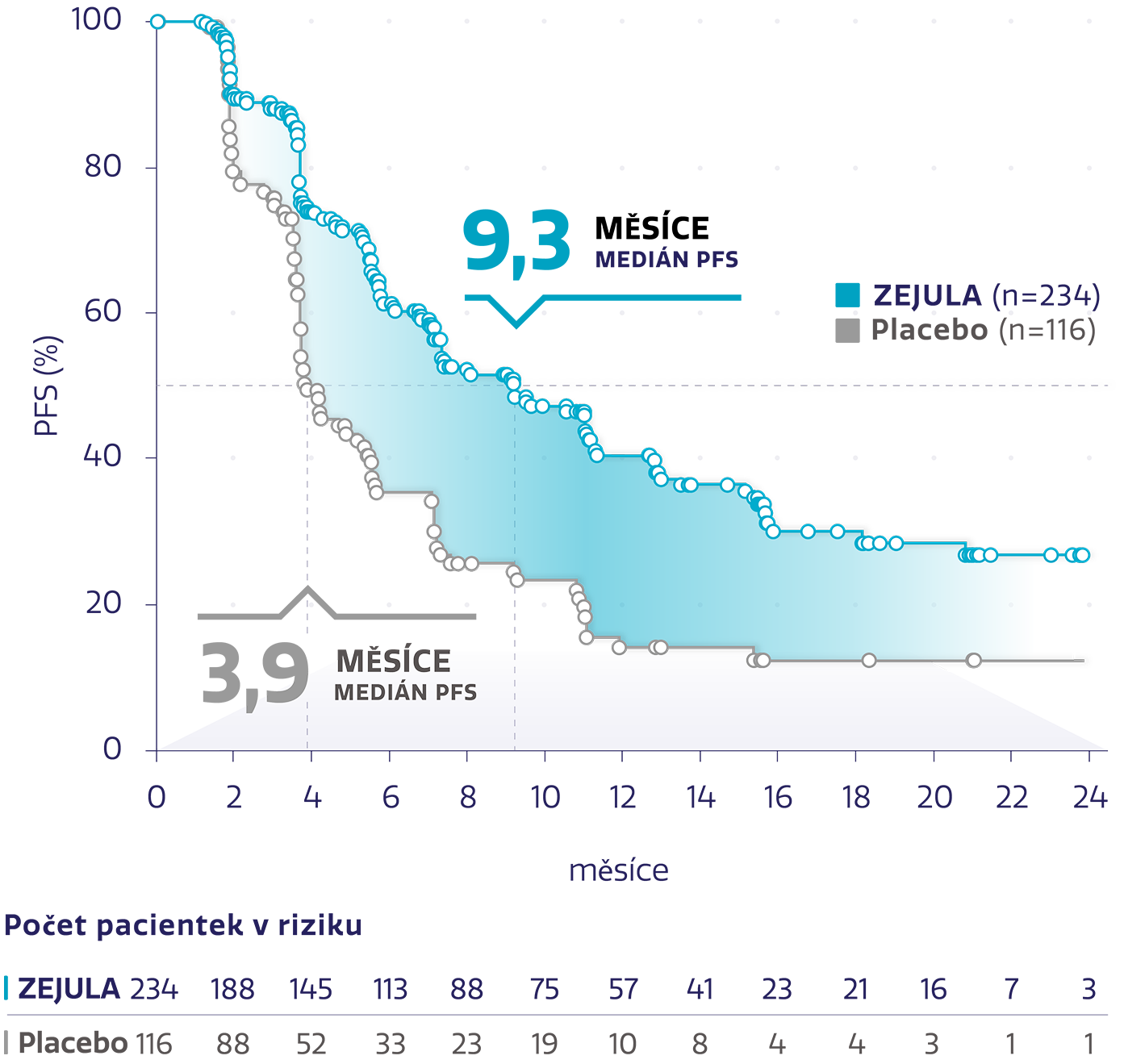
Obrázek převzat z Mirza MR, et al. 2016.2

snížení rizika progrese onemocnění nebo úmrtí oproti placebu2
HR: 0,45 (95% CI: 0,34-0,61), P<0,001

Odhad přežití bez pogrese ve 24 měsících stanoven na ~1 z 3
(27 % s přípravkem ZEJULA oproti 12 % s placebem)4
Pozorována přetrvávající účinnost bez ohledu na to, zda pacientky odpověděly na léčbu platinovou chemoterapií částečně nebo úplně2,3
PFS u pacientek s gBRCAm s PR na poslední chemoterapii na bázi platiny*3
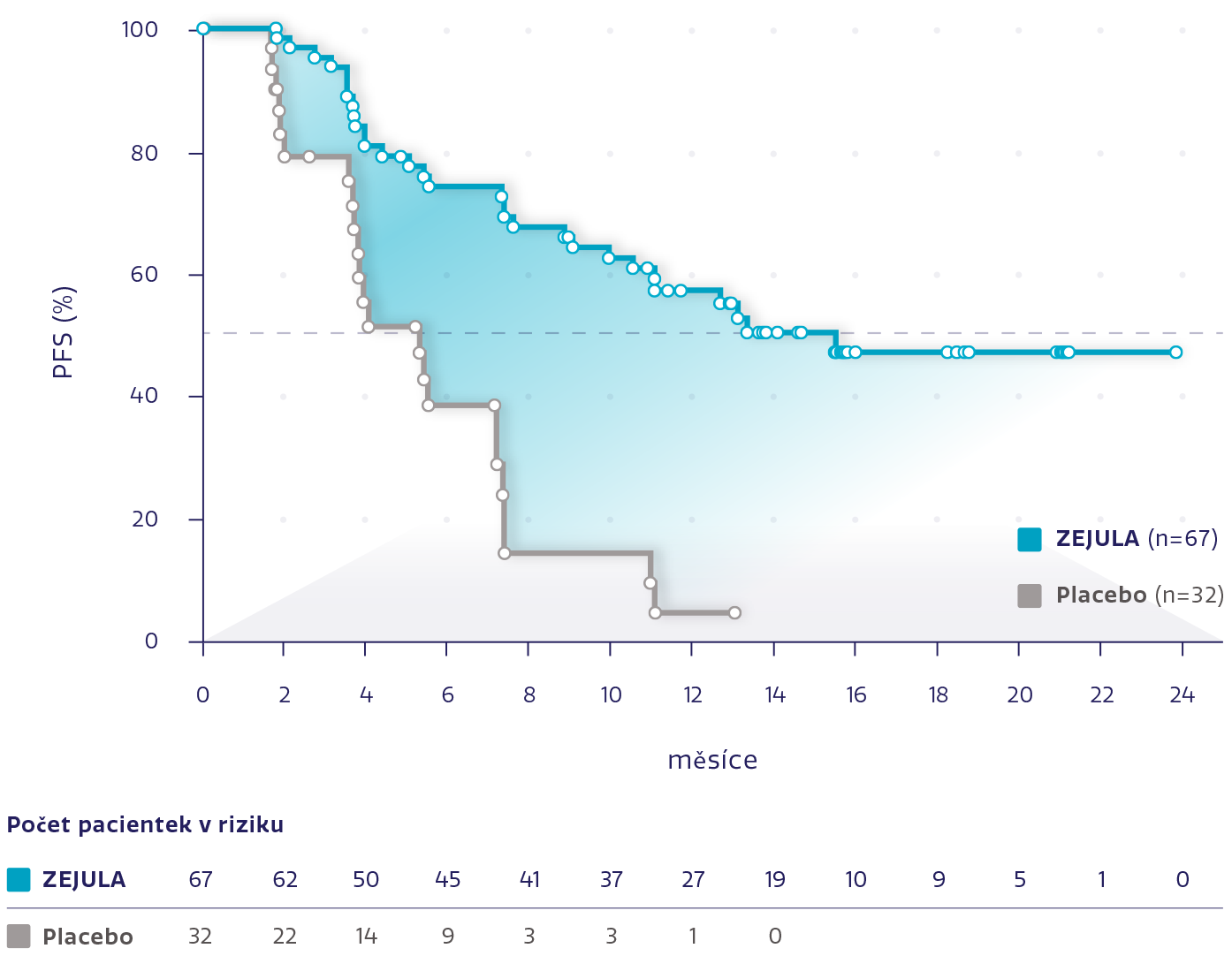
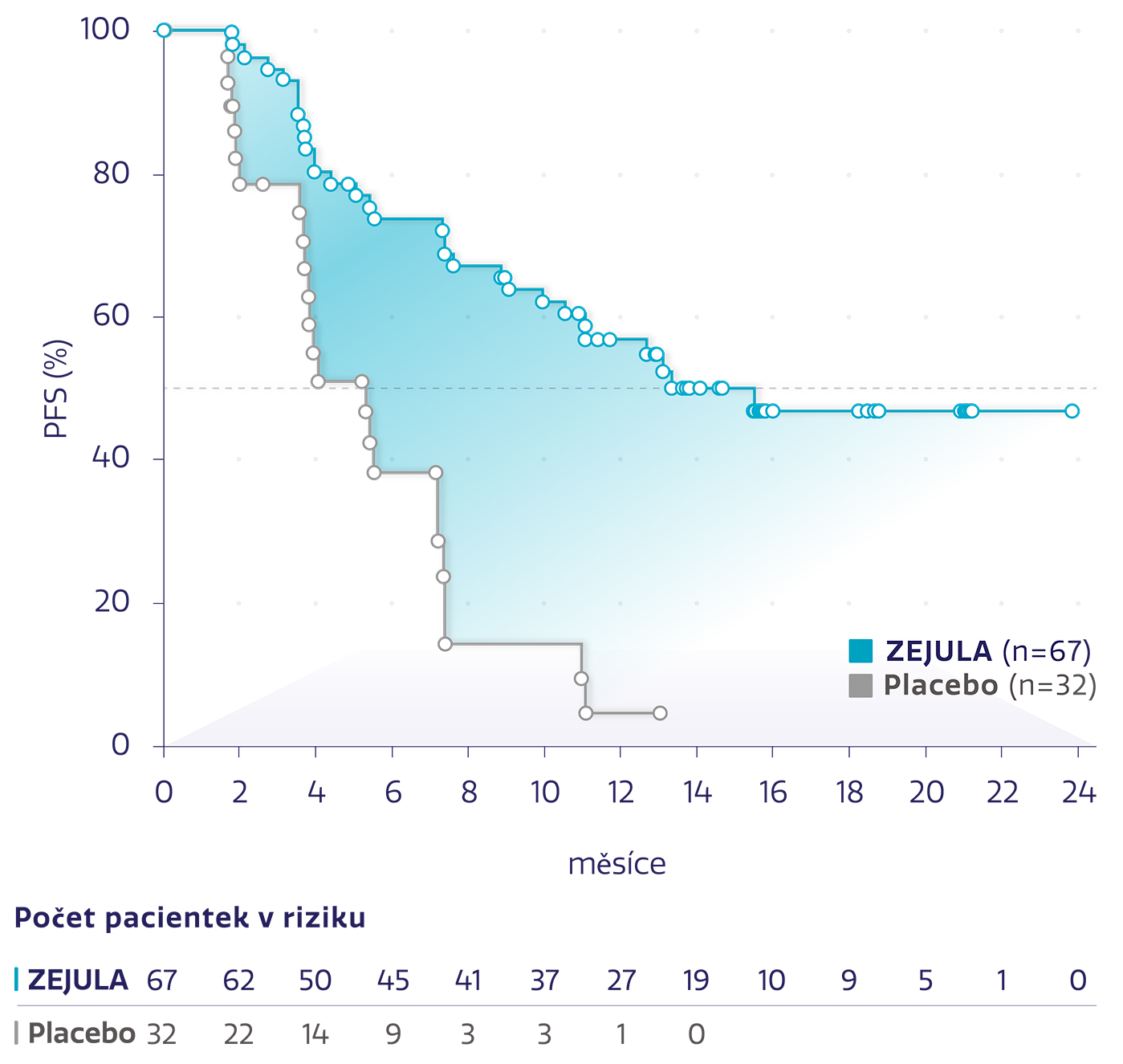
Obrázek převzat z Del Campo JM, et al. 2019.3

snížení rizika progrese onemocnění nebo úmrtí oproti placebu*3
HR: 0,24 (95% CI: 0,131-0,441), P < 0,0001
Přípravek ZEJULA také významně prodloužil medián PFS u pacientek s gBRCAm s kompletní odpovědí na poslední chemoterapii na bázi platiny oproti placebu (HR: 0,30; 95% CI: 0,160-0,546; P < 0,0001).*3
PFS u pacientek s non-gBRCAm s PR na poslední chemoterapii na bázi platiny*3
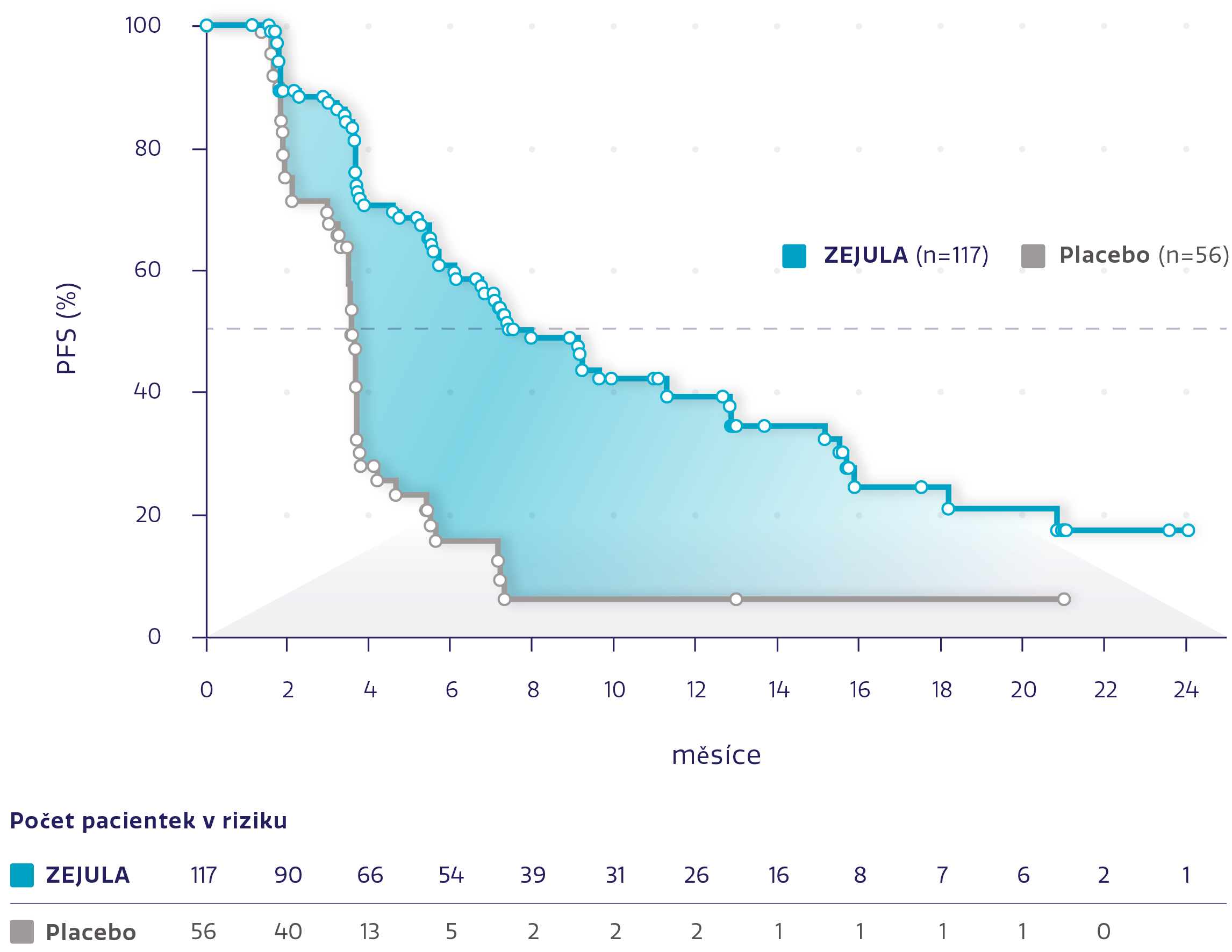
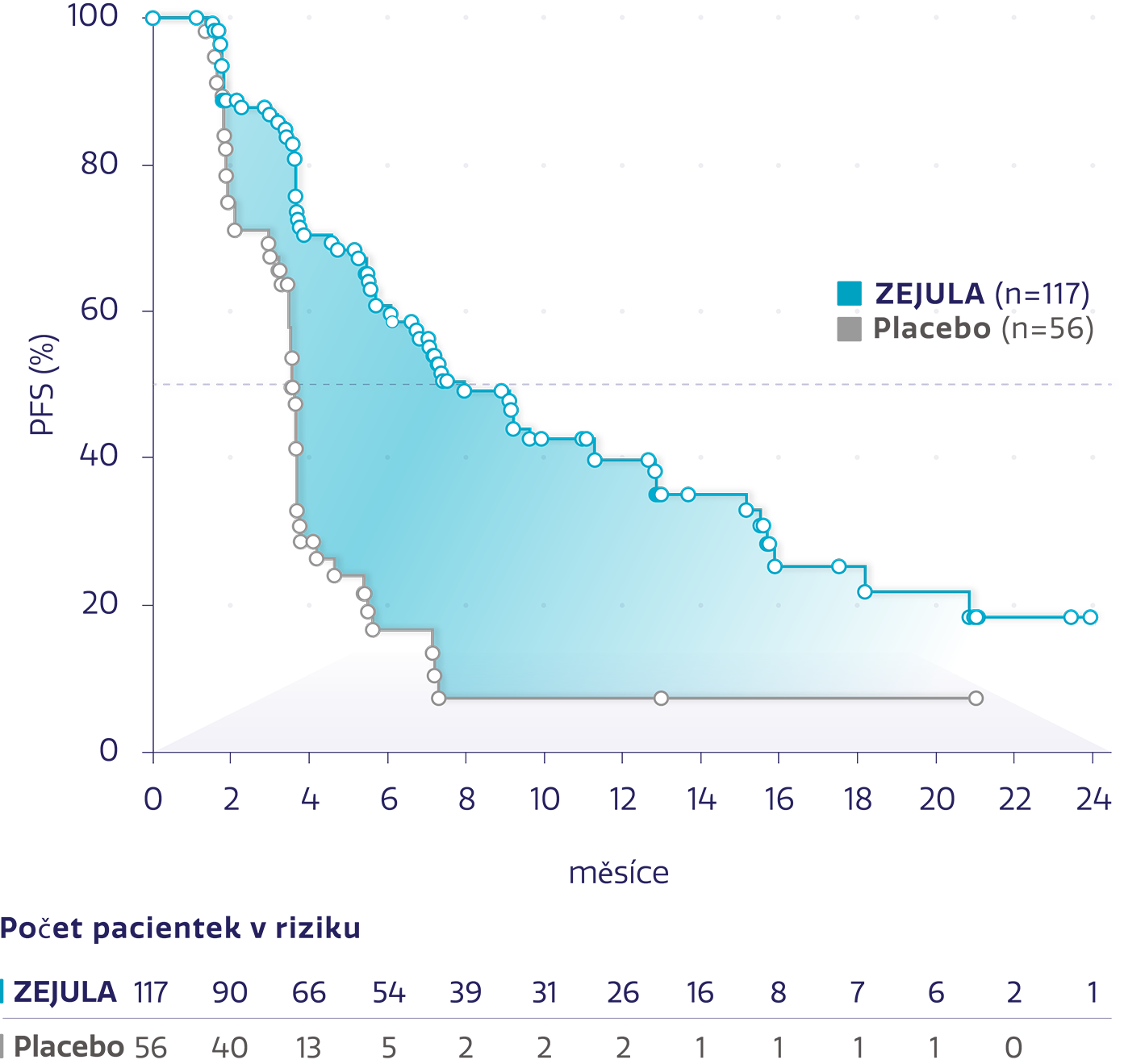
Obrázek převzat z Del Campo JM, et al. 2019.*3

snížení rizika progrese onemocnění nebo úmrtí oproti placebu*3
HR: 0,35 (95% CI: 0,230-0,532), P<0,0001
Přípravek ZEJULA také významně prodloužil medián PFS u pacientek s non-gBRCAm s kompletní odpovědí na poslední chemoterapii na bázi platiny oproti placebu (HR: 0,58; 95% CI: 0,383-0,868; P < 0,0082).*3
*Post hoc analýza k posouzení klinického přínosu a výsledků hlášených pacientkami u pacientek které měly PR a CR při poslední chemoterapii na bázi platiny.3
Zjistěte více o studii NOVA

Zkratky
BRCA, BReast CAncer gen; CI, interval spolehlivosti; CR, úplná odpověď; ENGOT, evropská síť skupin pro gynekologicko-onkologická klinická hodnocení (The European Network for Gynaecological Oncological Trial groups); gBRCAm, zárodečná mutace genu BRCA; non-gBRCAm, bez mutace gBRCA; HR, poměr rizik; PARP, poly(ADP-ribóza) polymeráza; PFS, přežití bez progrese; PR, částečná odpověď.
Reference
- SPC Zejula (niraparib), Souhrn údajů o přípravku Zejula, datum revize textu 05/2023
- Mirza MR, Monk BJ, Herrstedt J, et al. N Engl J Med. 2016;375(22):2154-2164.
- Del Campo JM, Matulonis UA, Malander S, et al. J Clin Oncol. 2019;37(32):2968-2973.
- Matulonis UA, Herrstedt J, Tinker AV, et al. Long-term benefit of niraparib treatment of recurrent ovarian cancer (OC). Poster presented at the American Society of Clinical Oncology (ASCO) 2017 Annual Meeting; Chicago, IL, USA, 2-6 June 2017. Poster 5534.
ZEJULA je registrovaný léčívý přípravek, jehož výdej je vázán na lékařský předpis a je hrazen z prostředků veřejného zdravotního pojištění v indikaci 1. linie udržovací léčby. Léčivý přípravek podléhá dalšímu sledování. Případná podezření na nežádoucí účinky nám prosím hlaste na cz.safety@gsk.com. Před předepsáním léku se, prosím, seznamte s úplnou informací o přípravku, kterou najdete v Souhrnu údajů o přípravku na www.gskkompendium.cz nebo se obraťte na společnost GlaxoSmithKline, s.r.o., Hvězdova 1734/2c, 140 00 Praha 4; e-mail: cz.info@gsk.com; www.gsk.cz.
© 2023 Skupina společností GSK nebo držitel licence.
Všechny uvedené ochranné známky jsou majetkem jejich příslušných vlastníků.
Schváleno: 09/2023; PM-CZ-NRP-WCNT-210001







