
Přípravek ZEJULA byl schválen v udržovací léčbě první linie s individualizovanou zahajovací dávkou1

Jednou denně
užívaná perorální monoterapie1

Užívá se kdykoli
během dne s jídlem nebo nalačno1

Nižší míra NÚ
s individualizovanou zahajovací dávkou při zachování účinnosti1–5
Odpovězte jednoduchým dávkováním jednou denně1
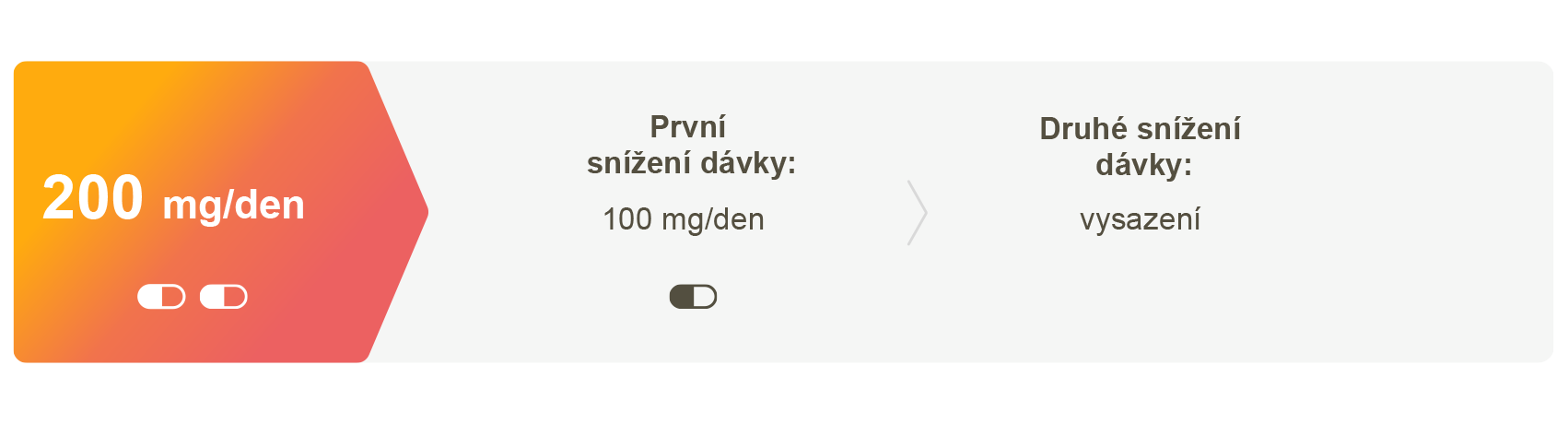
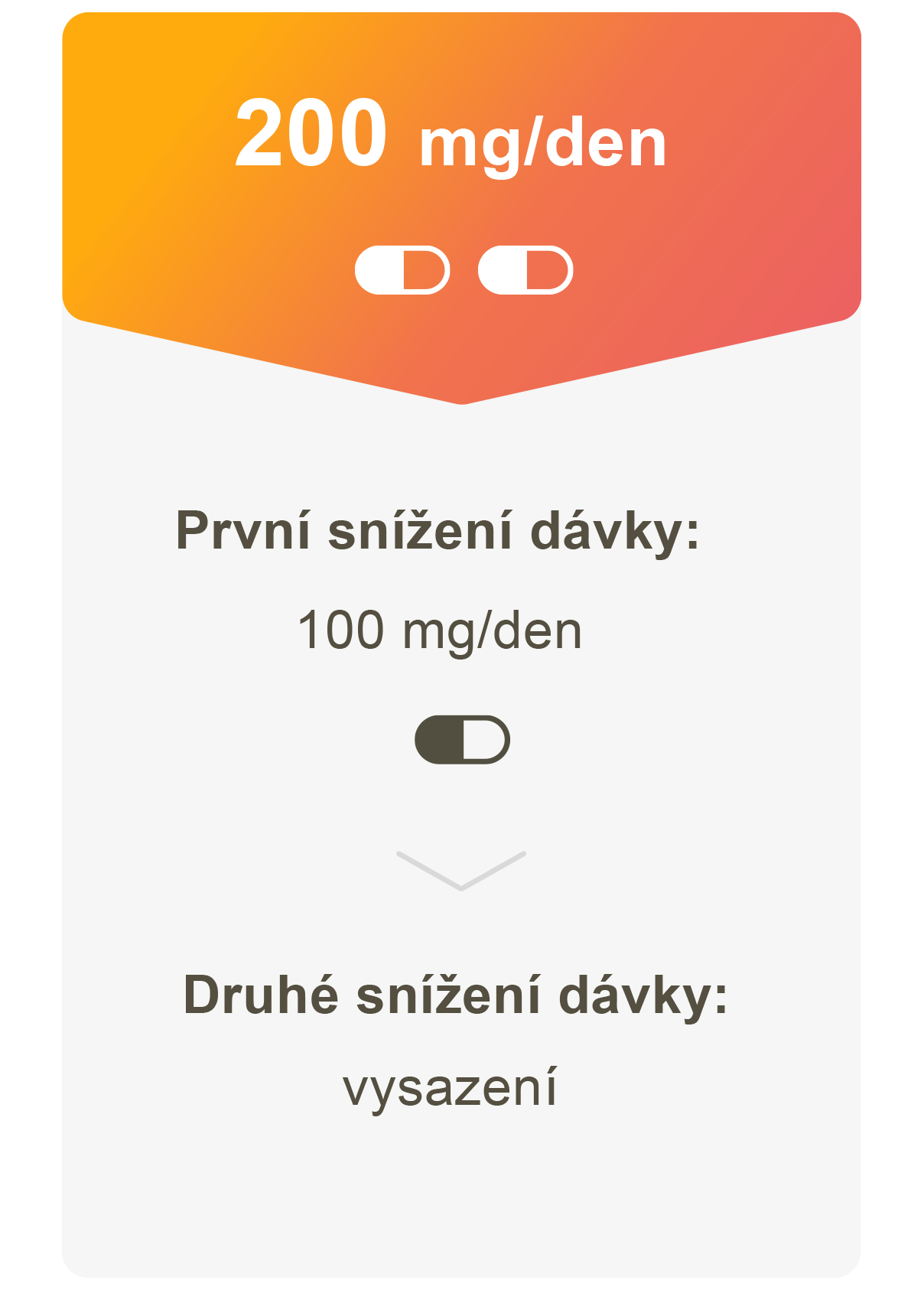
Při hmotnosti < 77 kg nebo výchozí počet trombocytů < 150 000/μl
Při hmotnosti ≥ 77 kg a výchozí počet trombocytů ≥ 150 000/µl

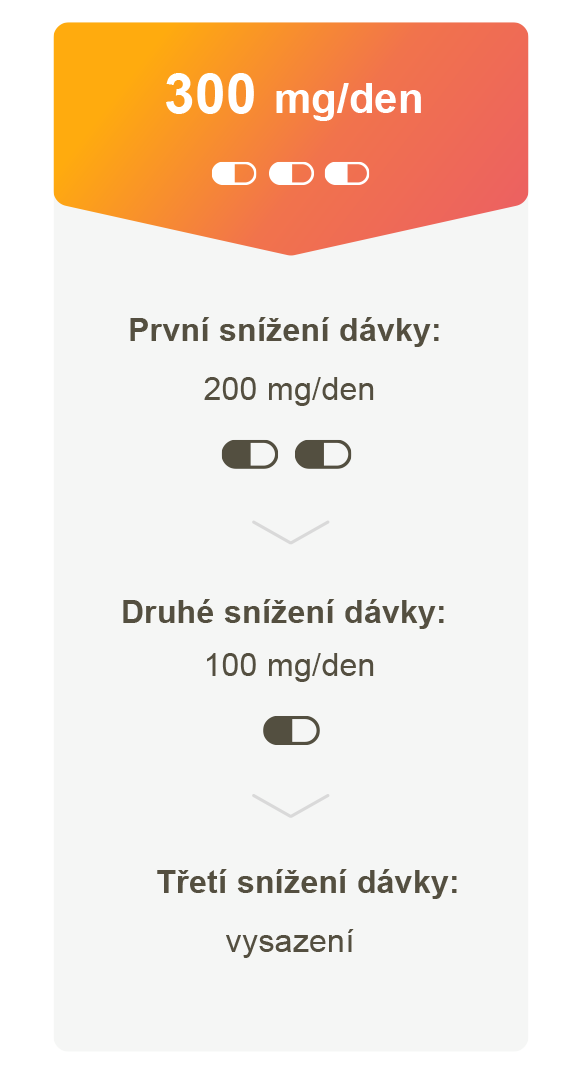
Sledování pomůže rozpoznat potřebu úpravy dávky1
Nižší míra NÚ s individualizovanou zahajovací dávkou při zachování účinnosti1–5

Zkratky
AE, nežádoucí příhoda; L, litry.
References
- SPC Zejula (niraparib), Souhrn údajů o přípravku Zejula, datum revize textu 05/2023
- Mirza MR, González-Martín A, Graybill W, et al. Evaluation of an individualized starting dose of niraparib in the PRIMA/ENGOT-OV26/GOG-3012 Study. Poster presented at the American Society of Clinical Oncology (ASCO) Congress; 29–31 May 2020. Poster 221.
- Korach J, Graybill W, Redondo A, et al. Niraparib in patients with newly diagnosed advanced ovarian BRCAm cancer: a post hoc analysis of the PRIMA/ENGOT-OV26/GOG-3012 trial. Abstract presented at the European Society of Gynaecological Oncology (ESGO) Congress; 14–16 December 2020. Abstract 571.
- GSK, Inc. Data on file. 2020 [list of adverse events by fixed versus individualised starting dose].
- GSK, Inc. Data on file. 2020. [Niraparib Global Data Sheet].
ZEJULA je registrovaný léčívý přípravek, jehož výdej je vázán na lékařský předpis a je hrazen z prostředků veřejného zdravotního pojištění v indikaci 1. linie udržovací léčby. Léčivý přípravek podléhá dalšímu sledování. Případná podezření na nežádoucí účinky nám prosím hlaste na cz.safety@gsk.com. Před předepsáním léku se, prosím, seznamte s úplnou informací o přípravku, kterou najdete v Souhrnu údajů o přípravku na www.gskkompendium.cz nebo se obraťte na společnost GlaxoSmithKline, s.r.o., Hvězdova 1734/2c, 140 00 Praha 4; e-mail: cz.info@gsk.com; www.gsk.cz.
© 2023 Skupina společností GSK nebo držitel licence.
Všechny uvedené ochranné známky jsou majetkem jejich příslušných vlastníků.
Schváleno: 09/2023; PM-CZ-NRP-WCNT-210001









