

V souladu
se zkušenostmi z předchozích klinických hodnocení1,2

Pouze 12%
míra trvalého vysazení léčby s přípravkem ZEJULA2

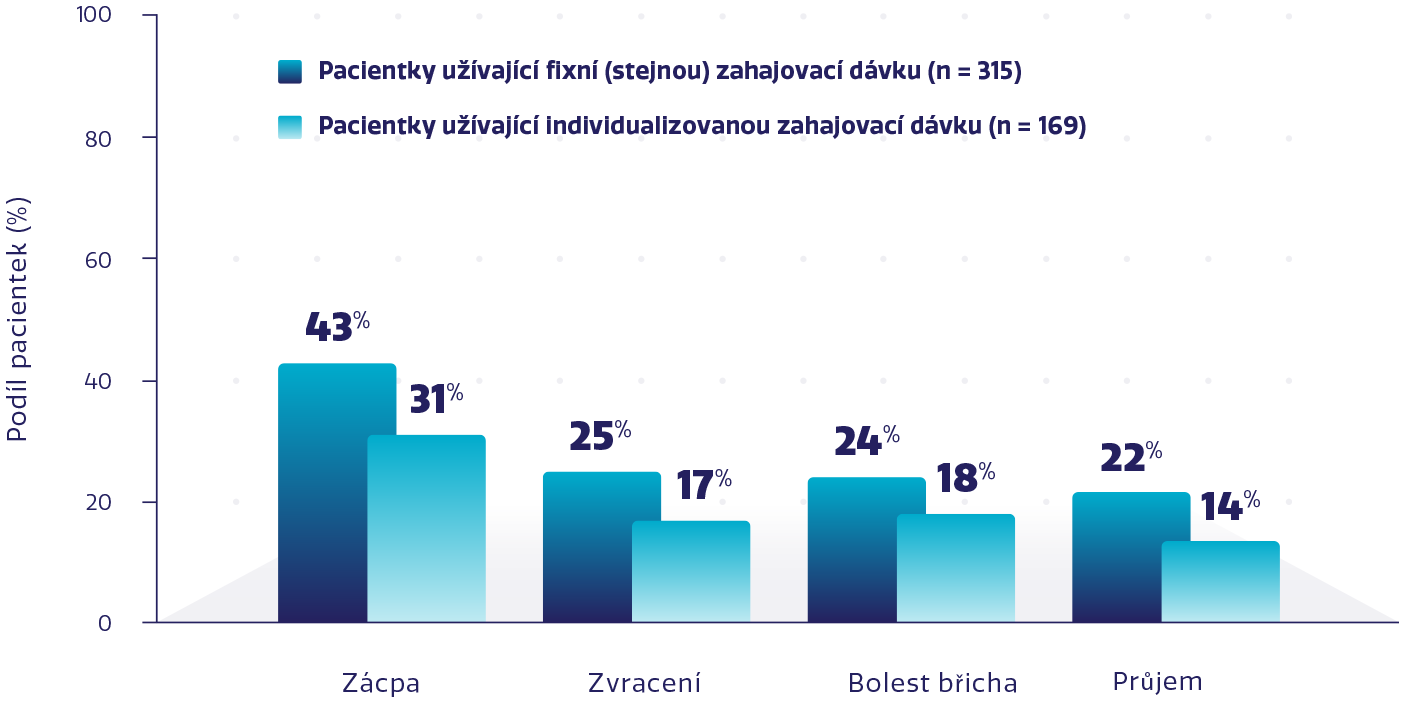
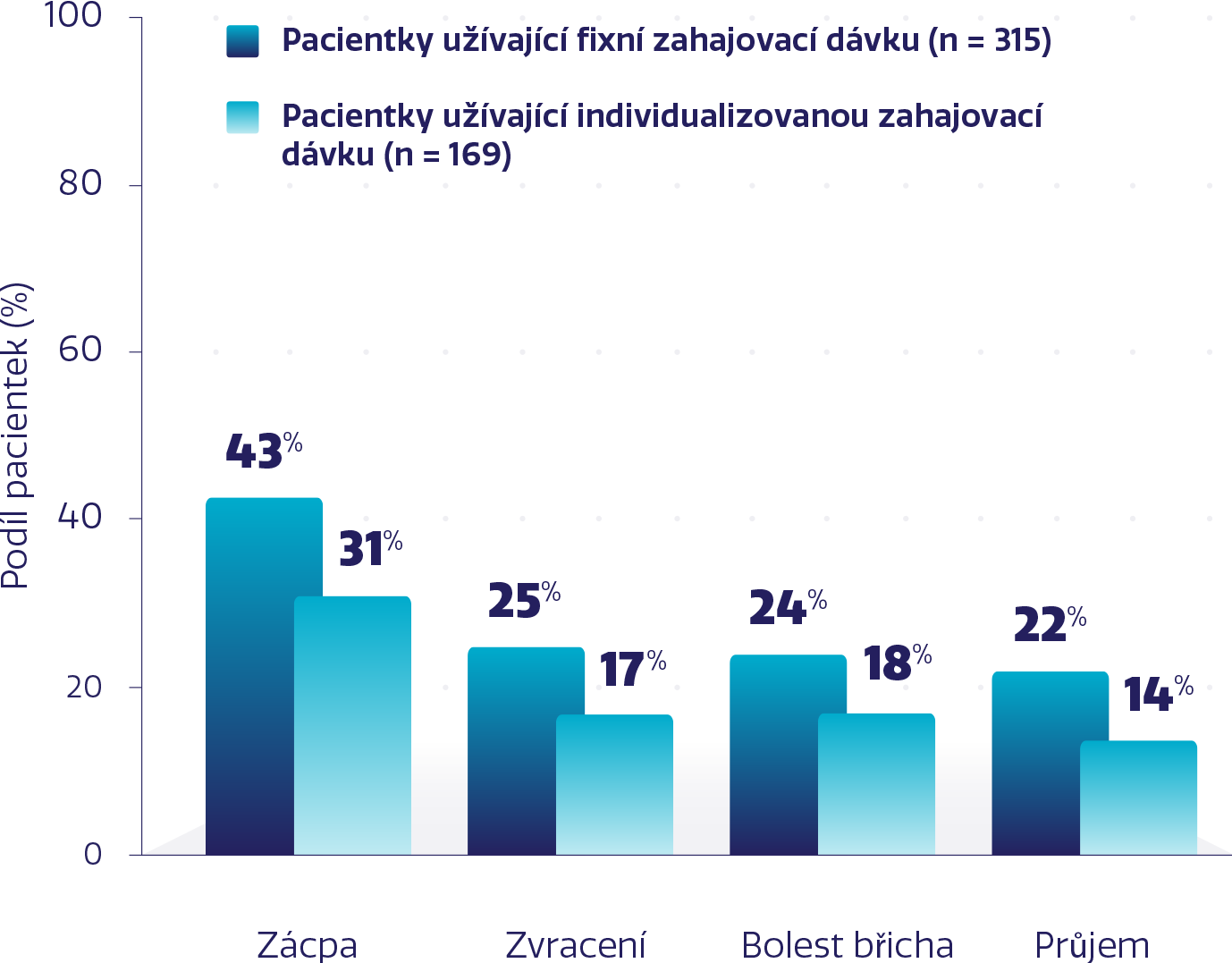
Nižší míra NÚ
s individualizovanou zahajovací dávkou při zachování účinnosti*1,3-6
Nejčastější NÚ u ≥ 20 % pacientek léčených přípravkem ZEJULA2
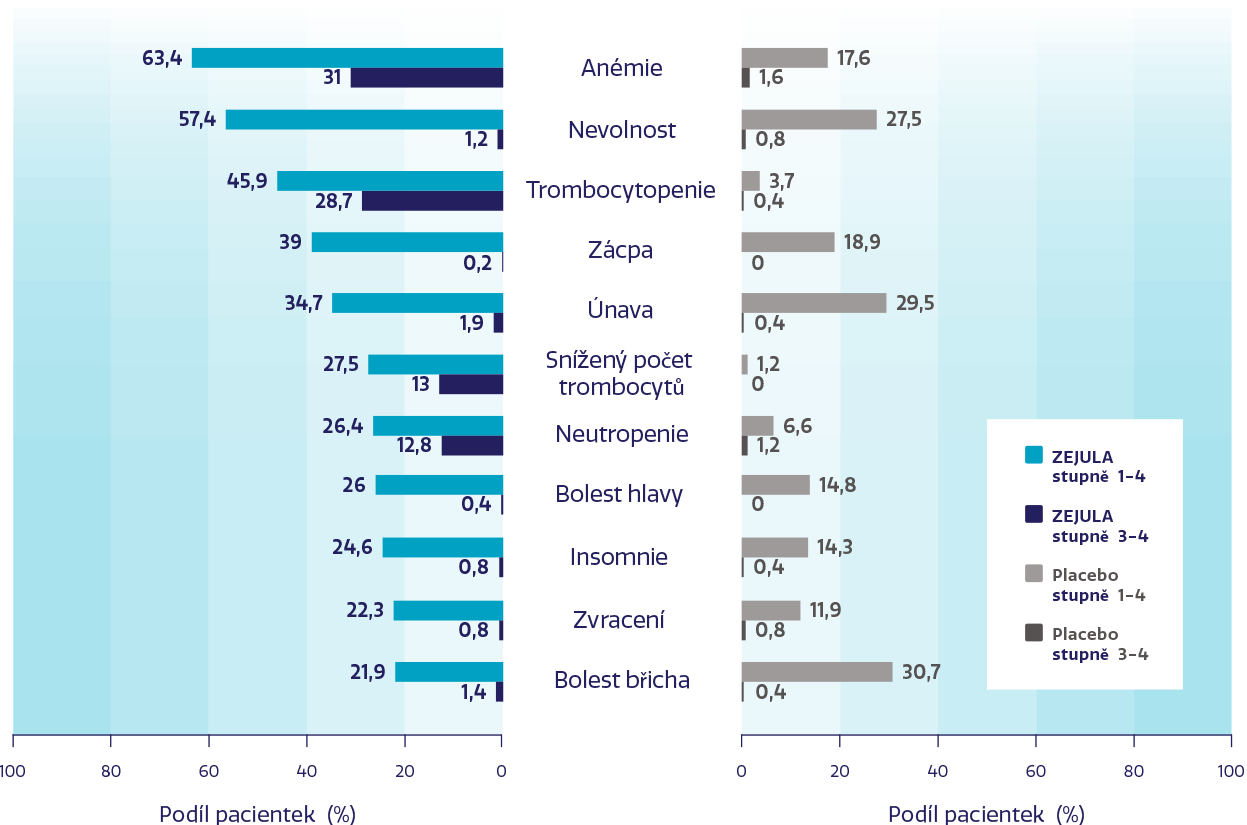
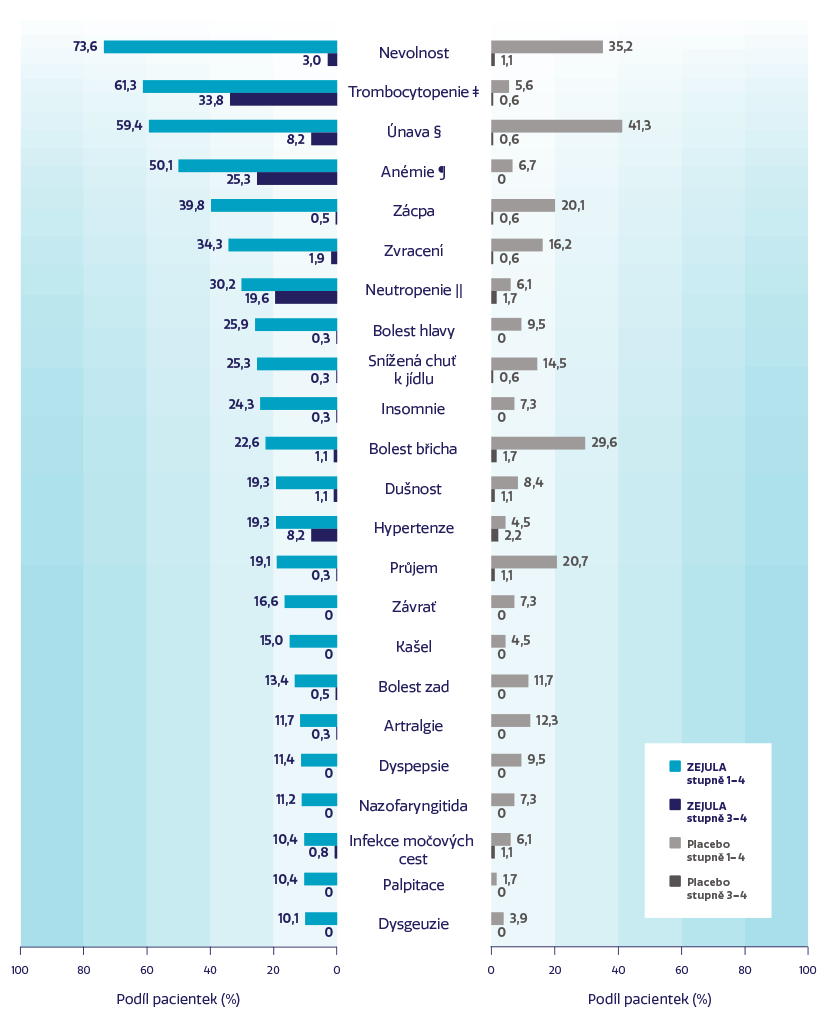
Nejběžnějšími závažnými NÚ byly trombocytopenie a anémie.1

Pouze 12 % pacientek trvale vysadilo léčbu přípravkem ZEJULA kvůli NÚ.†2
†V porovnání s 2,5 % u skupiny s placebem.2 K vysazení léčby v důsledku trombocytopenie, anémie a neutropenie došlo u 3 %, 3 %, respektive 2 % pacientek.1
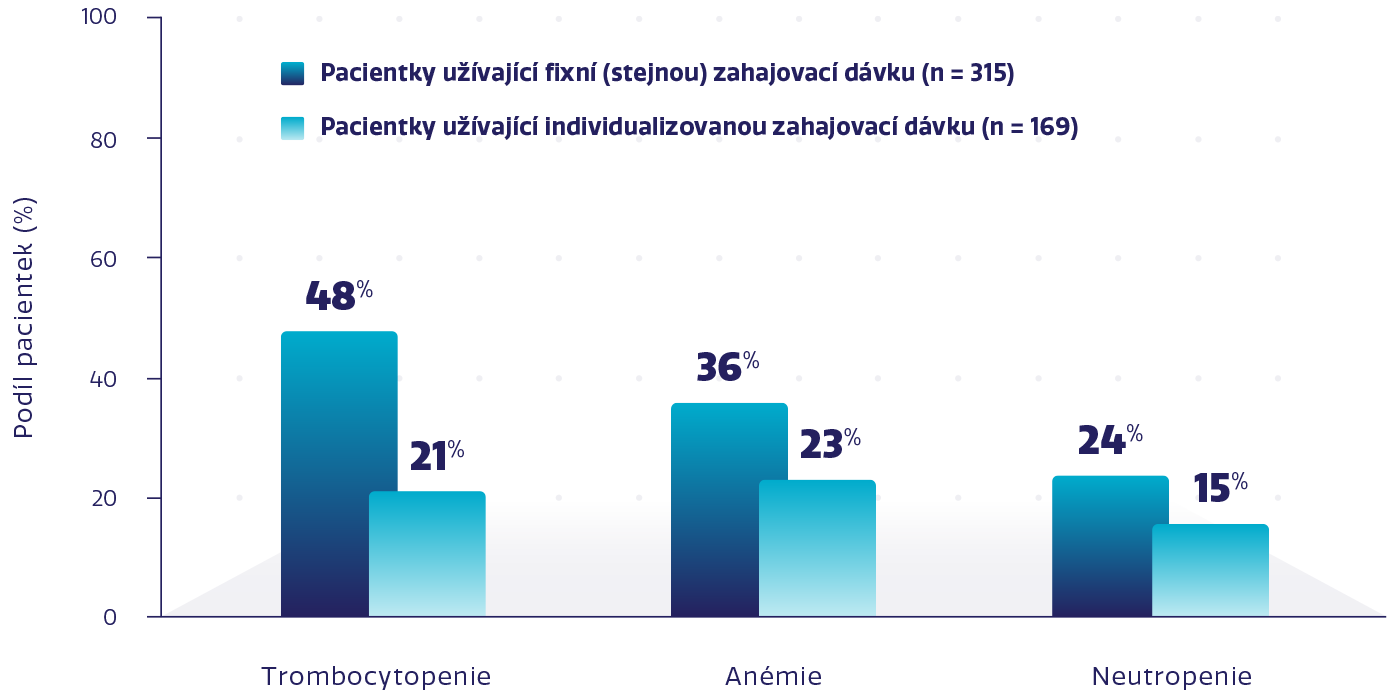
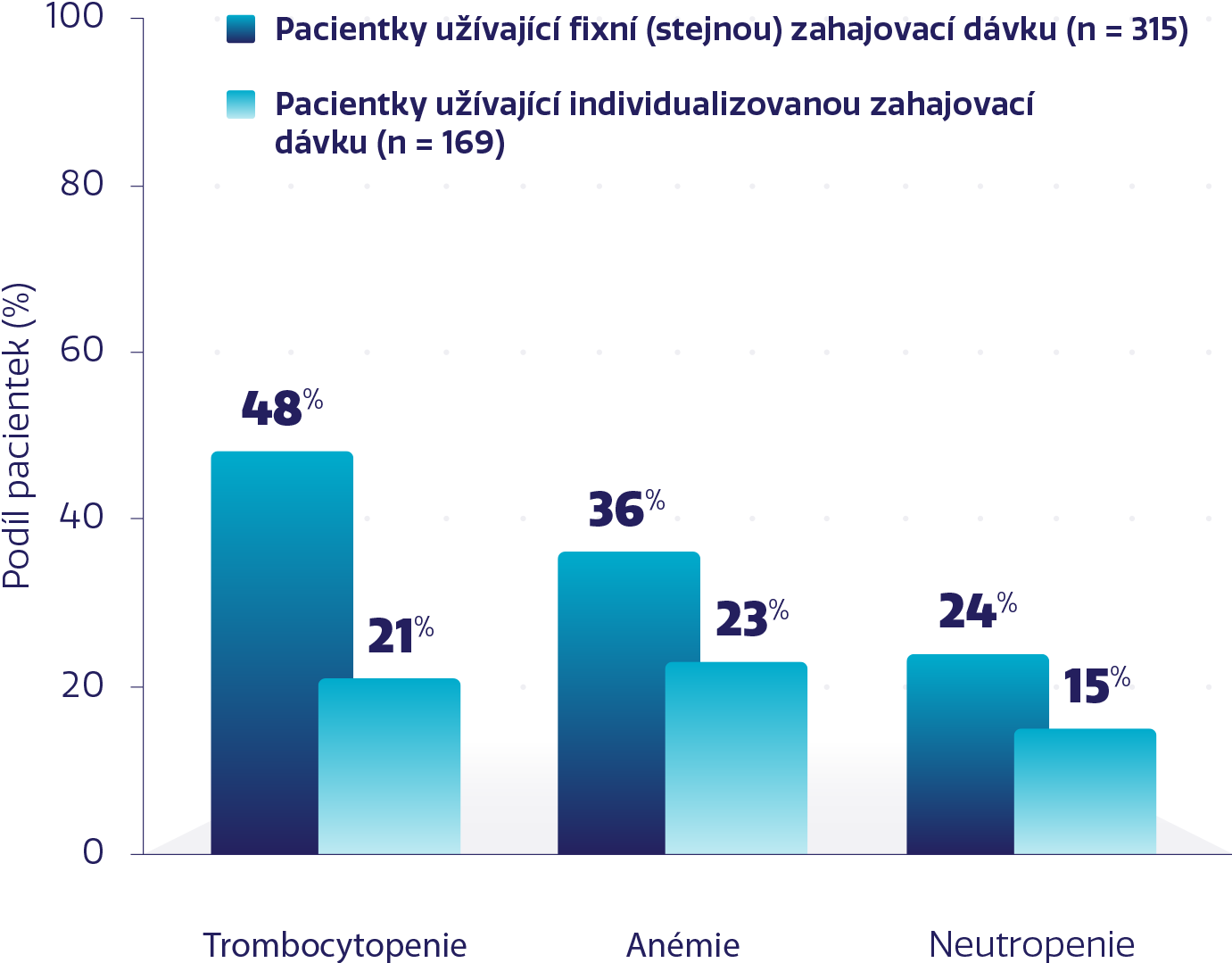
Nižší míra NÚ s individualizovanou zahajovací dávkou při zachování účinnosti*1,3-6
Míra vybraných hematologických NÚ stupně 3-4 s přípravkem ZEJULA3
S individualizovanou zahajovací dávkou je zachována účinnost*1,6

Celková populace:HR: 0,69
(95% CI: 0,48-0,98)
Studie PRIMA prospektivně vyhodnotila bezpečnost a účinnost individualizované zahajovací dávky 200 mg nebo 300 mg stejně jako u fixní zahajovací dávky.Individualizovaná dávka byla stanovená na základě výchozí hmotnosti a počtu trombocytů.1,2
Míra vybraných symptomatických gastrointestinálních NÚ stupně 1-4 s přípravkem ZEJULA5
S individualizovanou zahajovací dávkou je zachována účinnost*1,6

Celková populace: HR: 0,69
(95% CI: 0,48-0,98)
Studie PRIMA prospektivně vyhodnotila bezpečnost a účinnost individualizované zahajovací dávky 200 mg nebo 300 mg stejně jako u fixní zahajovací dávky.Individualizovaná dávka byla stanovená na základě výchozí hmotnosti a počtu trombocytů.1,2
U pacientek s BRCAm, které užívaly individualizovanou zahajovací dávku podle hmotnosti a počtu trombocytů, bylo pozorováno:

snížení rizika progrese nebo úmrtí s přípravkem ZEJULA oproti placebu*4
HR: 0,29 (95% CI: 0,13-0,67)
U pacientek s HRd, které užívaly individualizovanou zahajovací dávku podle hmotnosti a počtu trombocytů, bylo pozorováno:

snížení rizika progrese nebo úmrtí s přípravkem ZEJULA oproti placebu*4
HR: 0,39 (95% CI: 0,22-0,72)
* Tato analýza je výzkumné povahy a nesloužila ke zjištění statisticky významného účinku léčby. Proto je třeba výsledky interpretovat s opatrností.
Vedlejší účinky lze kontrolovat přerušením a úpravou dávky1,2
Ve studii PRIMA vedly nežádoucí příhody k přerušení dávky dávky u 79,5%, a ke snížení u 70,9% pacientek, které dostávaly přípravek ZEJULA.2

Nebyly zaznamenány žádné specifické vzájemné lékové interakce s přípravkem ZEJULA.‡1
‡ Nebyly provedeny žádné klinické studie vzájemné lékové interakce s přípravkem ZEJULA.
Přípravek ZEJULA je jediný PARP inhibitor podávaný pouze jednou denně schválený jako udržovací léčba první linie s individualizovanou zahajovací dávkou1,7,8

Zkratky
NÚ, nežádoucí účinek; BRCA, BReast CAncer gen; BRCAm, mutace BRCA; CI, interval spolehlivosti; HR, poměr rizik; HRd, deficit homologní rekombinace; PARP, poly(ADP-ribóza) polymeráza.
Reference
- SPC Zejula (niraparib), Souhrn údajů o přípravku Zejula, datum revize textu 05/2023
- González-Martín A, Pothuri B, Vergote I, et al. N Engl J Med. 2019;381(25):2391-2402.
- Mirza MR, González-Martín A, Graybill W, et al. Evaluation of an individualized starting dose of niraparib in the PRIMA/ENGOT-OV26/GOG-3012 Study. Poster presented at the American Society of Clinical Oncology (ASCO) Congress; 29-31 May 2020. Poster 221.
- Korach J, Graybill W, Redondo A, et al. Niraparib in patients with newly diagnosed advanced ovarian BRCAm cancer: a post hoc analysis of the PRIMA/ENGOT-OV26/GOG-3012 trial. Abstract presented at the European Society of Gynaecological Oncology (ESGO) Congress; 14-16 December 2020. Abstract 571.
- GSK, Inc. Data on file. 2020 [list of adverse events by fixed versus individualised starting dose].
- GSK, Inc. Data on file. 2020. [Niraparib Global Data Sheet].
- Lynparza (olaparib). Souhrn údajů o přípravku. 2021
- Rubraca (rucaparib). Souhrn údajů o přípravku. 2021
ZEJULA je registrovaný léčívý přípravek, jehož výdej je vázán na lékařský předpis a je hrazen z prostředků veřejného zdravotního pojištění v indikaci 1. linie udržovací léčby. Léčivý přípravek podléhá dalšímu sledování. Případná podezření na nežádoucí účinky nám prosím hlaste na cz.safety@gsk.com. Před předepsáním léku se, prosím, seznamte s úplnou informací o přípravku, kterou najdete v Souhrnu údajů o přípravku na www.gskkompendium.cz nebo se obraťte na společnost GlaxoSmithKline, s.r.o., Hvězdova 1734/2c, 140 00 Praha 4; e-mail: cz.info@gsk.com; www.gsk.cz.
© 2023 Skupina společností GSK nebo držitel licence.
Všechny uvedené ochranné známky jsou majetkem jejich příslušných vlastníků.
Schváleno: 09/2023; PM-CZ-NRP-WCNT-210001





