

Prokázaná účinnost
bez ohledu na stav biomarkerů1,2

Dvojnásobný
medián PFS oproti placebu u pacientek s HRd1,2
HR: 0,43 (95% CI: 0,31-0,59), P < 0,0001

60% snížení
rizika progrese nebo úmrtí oproti placebu pozorované u pacientek s BRCAm*3 HR: 0,40 (95% CI: 0,27-0,62)
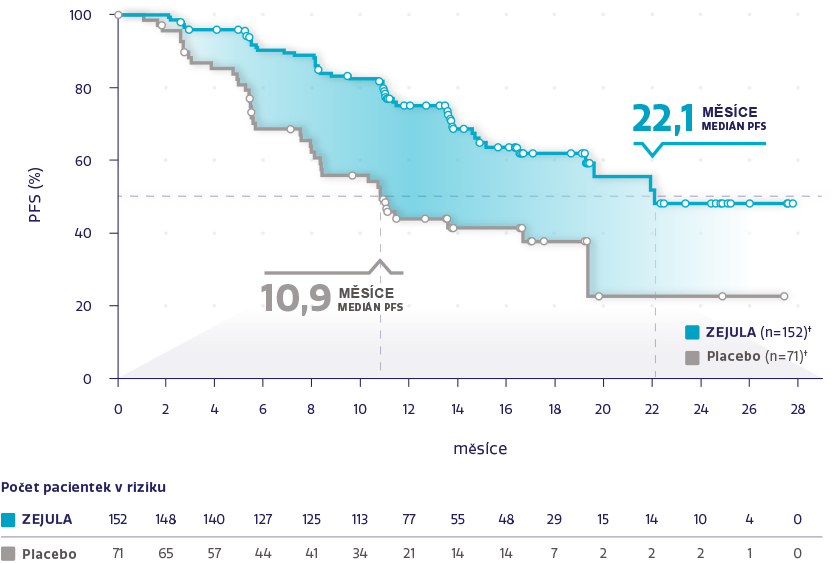
Významně delší medián PFS oproti placebu bez ohledu na stav biomarkerů1,2
PFS u celkové populace (N = 733)1,2
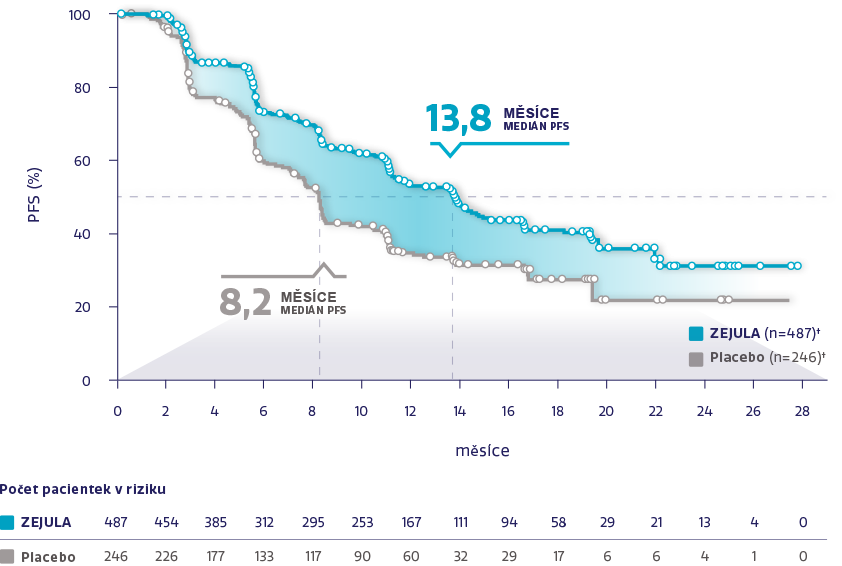
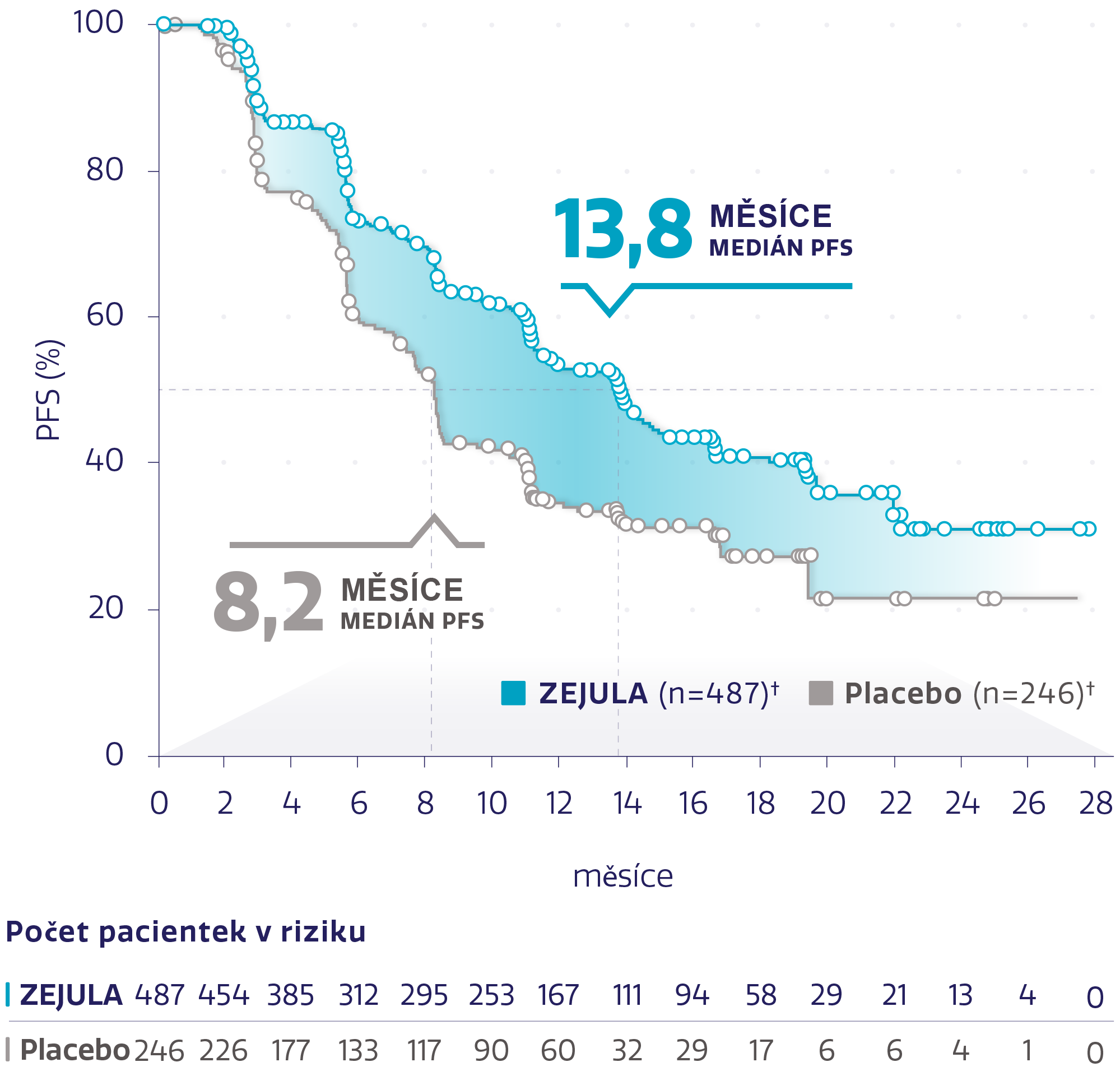
Obrázek převzat z González-Martín A, et al. 2019.2
†Cenzurované subjekty jsou označeny kroužky.
Složení celkové populace (ITT):‡1

U pacientek s HRp bylo u přípravku ZEJULA pozorováno 32% snížení rizika progrese nebo úmrtí oproti placebu*2
(HR: 0,68, 95% CI: 0,49-0,94)
‡ U 111 pacientek ve studii PRIMA nebylo možné určit stav homologní rekombinace.2
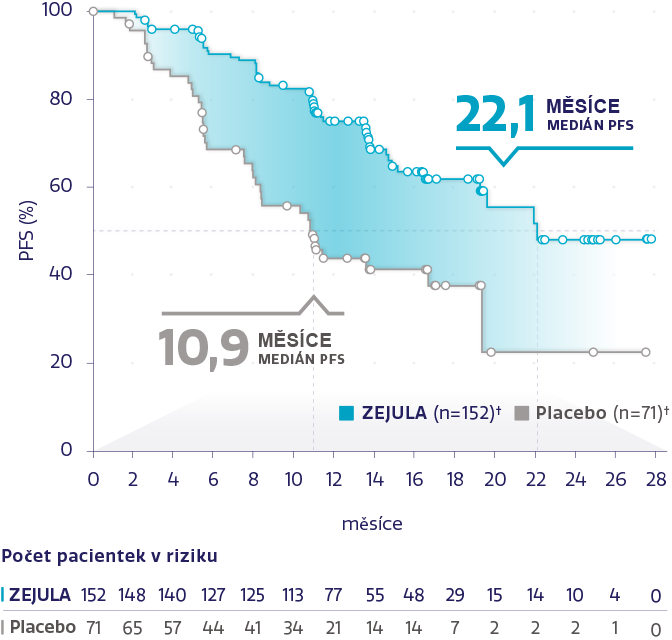
PFS v populaci s HRd (n = 373)1,2
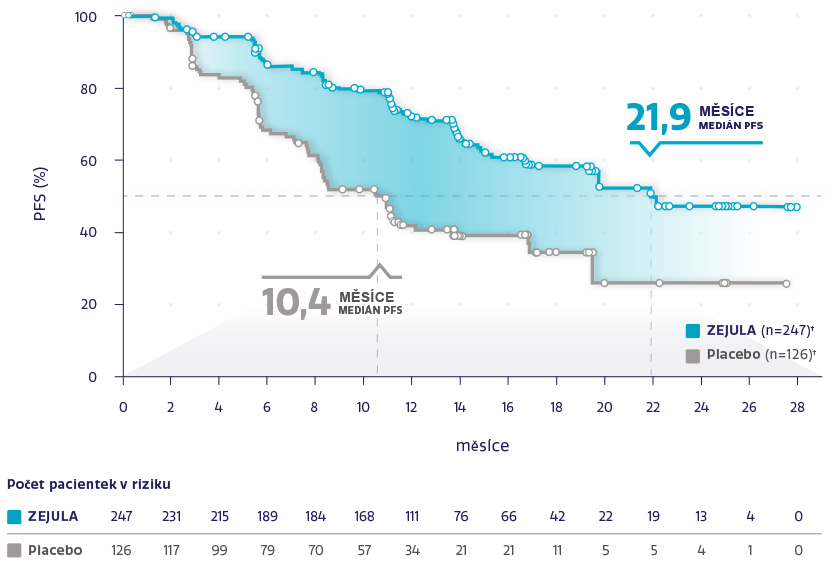
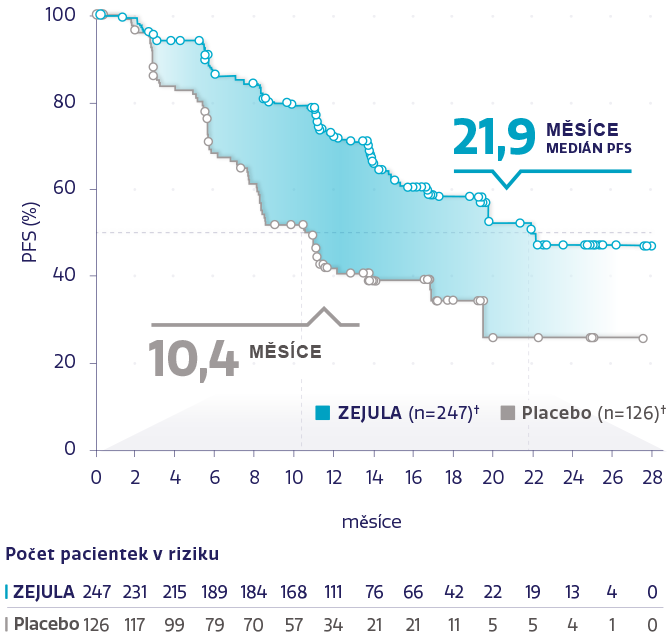
Obrázek převzat z González-Martín A, et al. 2019.2
†Cenzurované subjekty jsou označeny kroužky.

snížení rizika progrese onemocnění nebo úmrtí oproti placebu1,2
HR: 0,43 (95% CI: 0,31-0,59), P < 0,0001
62 % pacientek v populaci s HRd mělo BRCAm.2
U všech pacientek s HRd byla pozorována konzistentní účinnost bez ohledu na stav BRCA2,3
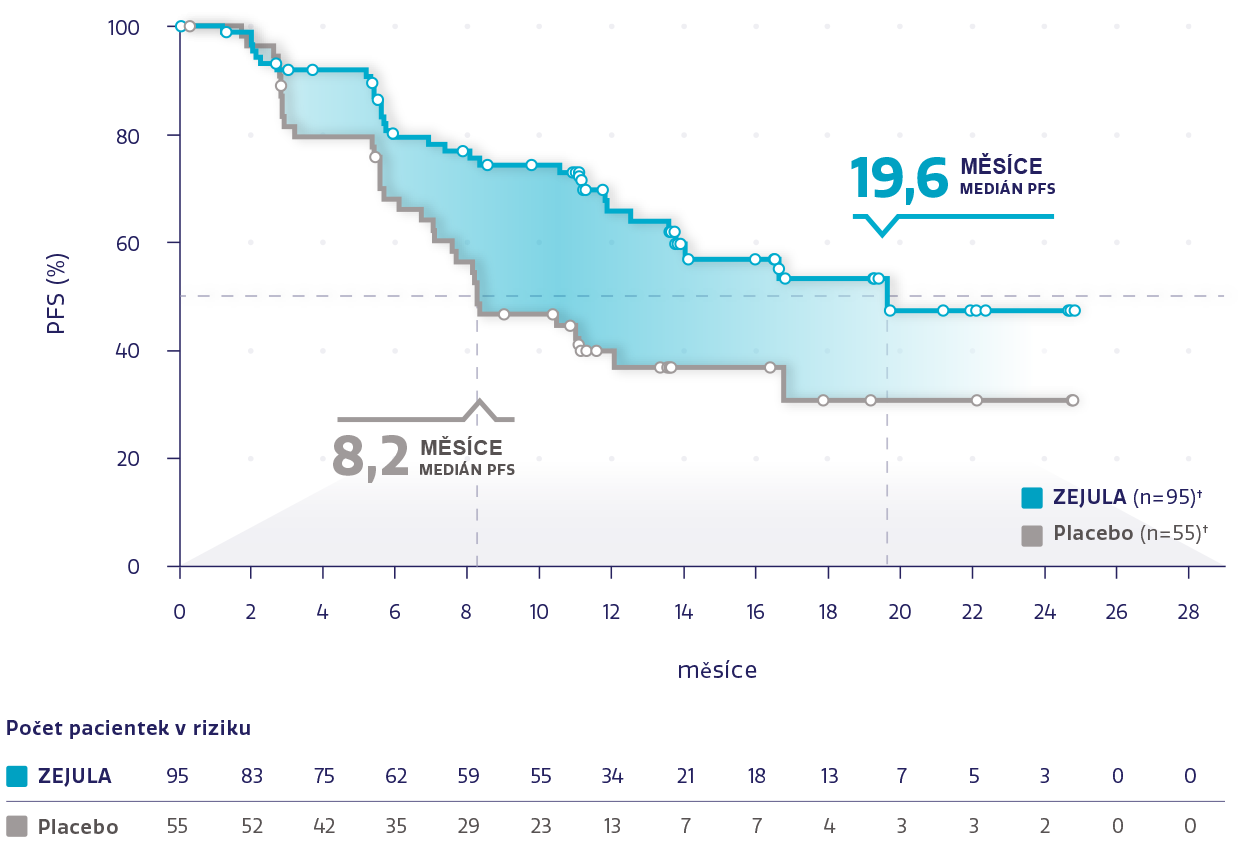
PFS v populaci s HRd s mutací BRCAm (n = 223)*2,3
Obrázek převzat z Monk BJ et al. 2020.3
†Cenzurované subjekty jsou označeny kroužky.

snížení rizika progrese onemocnění nebo úmrtí oproti placebu*3
HR: 0,40 (95% CI: 0,27-0,62)
PFS v populaci s HRd s BRCAwt (n = 150)*2,3
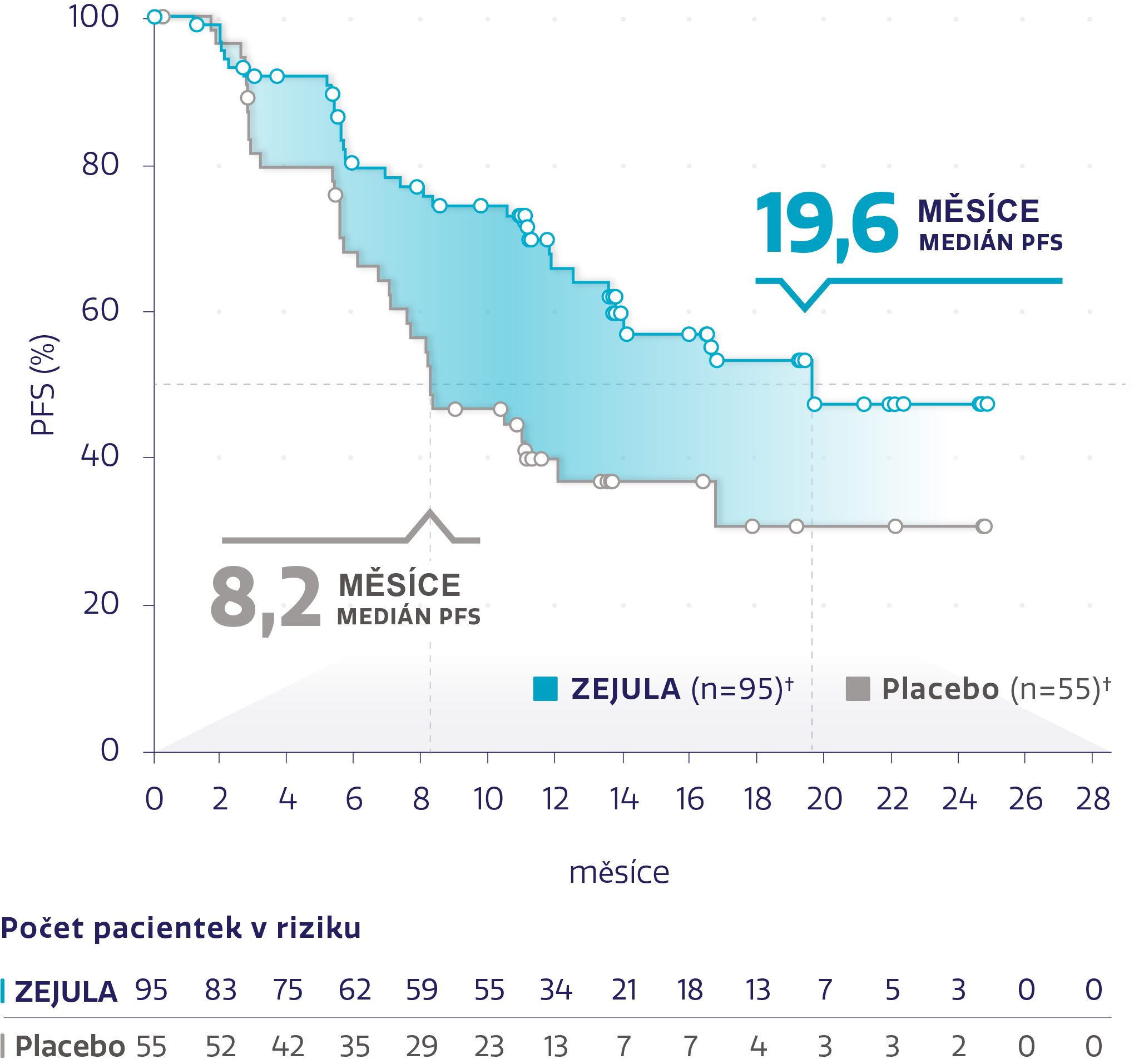
Obrázek převzat z Monk BJ et al. 2020.3
†Cenzurované subjekty jsou označeny kroužky.

snížení rizika progrese onemocnění nebo úmrtí oproti placebu*3
HR: 0,50 (95% CI: 0,31-0,83)
* Tato analýza je výzkumné povahy a nesloužila ke zjištění statisticky významného účinku léčby. Proto je třeba výsledky interpretovat s opatrností.
Přípravek ZEJULA je jediný PARP inhibitor podávaný jednou denně schválený pro udržovací léčbu první linie s individualizovanou zahajovací dávkou1,4,5
Studie PRIMA hodnotila přípravek ZEJULA u široké škály pacientek1,2

Zkratky
BRCA, BReast CAncer gen; BRCAm, mutace BRCA; BRCAwt, divoký typ BRCA; CI, interval spolehlivosti; GIS, stav genomové nestability; HR, poměr rizik; HRd, deficit homologní rekombinace; HRp, schopnost homologní rekombinace (HR proficientní); PARP, poly(ADP-ribóza) polymeráza; PFS, přežití bez progrese.
Reference
- SPC Zejula (niraparib), Souhrn údajů o přípravku Zejula, datum revize textu 05/2023
- González-Martín A, Pothuri B, Vergote I, et al. N Engl J Med. 2019;381(25):2391-2402.
- Monk BJ, Han S, Pothuri B, et al. Efficacy of Niraparib Therapy in Patients With Newly Diagnosed Advanced Ovarian Cancer by BRCA and Homologous Recombination Status: PRIMA/ENGOT-OV26/GOG-3012 Study. Poster presented at the Society of Gynecologic Oncology (SGO) 2020 Webinar Series.
- Lynparza (olaparib). Souhrn údajů o přípravku. 2021
- Rubraca (rucaparib). Souhrn údajů o přípravku. 2021
- Supplementary Appendix to: González-Martín A, Pothuri B, Vergote I, et al. N Engl J Med. 2019;381(25):2391-2402.
- Horowitz NS, Miller A, Rungruang B, et al. J Clin Oncol. 2015;33(8):937-943.
- Chang S-J, Hodeib M, Chang J, et al. Gynecol Oncol. 2013;130(3):493-498.
- Davis A, Tinker AV, Friedlander M. Gynecol Oncol. 2014;133(3):624-631.
- GSK, Inc. Data on file. 2020. 2020N435433_00.
ZEJULA je registrovaný léčívý přípravek, jehož výdej je vázán na lékařský předpis a je hrazen z prostředků veřejného zdravotního pojištění v indikaci 1. linie udržovací léčby. Léčivý přípravek podléhá dalšímu sledování. Případná podezření na nežádoucí účinky nám prosím hlaste na cz.safety@gsk.com. Před předepsáním léku se, prosím, seznamte s úplnou informací o přípravku, kterou najdete v Souhrnu údajů o přípravku na www.gskkompendium.cz nebo se obraťte na společnost GlaxoSmithKline, s.r.o., Hvězdova 1734/2c, 140 00 Praha 4; e-mail: cz.info@gsk.com; www.gsk.cz.
© 2023 Skupina společností GSK nebo držitel licence.
Všechny uvedené ochranné známky jsou majetkem jejich příslušných vlastníků.
Schváleno: 09/2023; PM-CZ-NRP-WCNT-210001











