Buďme ambiciózní v léčbě astmatu
Ambicióznímu cíli v léčbě těžkého astmatu – dosažení remise onemocnění – bylo věnováno sympozium společnosti GlaxoSmithKline na kongresu ČPFS a XXXII. moravskoslezských pneumologických dnech, které proběhly 26.–28. 9. 2024 v Ostravě. Doc. MUDr.Norbert Pauk, Ph.D. ve své přednášce ukázal, že tohoto cíle lze dnes díky biologické léčbě dosáhnout. Rozebral roli interleukinu-5 (IL-5) v patofyziologii astmatu vedoucí k dysfunkci epitelové bariéry, imunitní nerovnováze a tvorbě hlenových zátek a ukázal, že právě cílení na IL-5 pomocí mepolizumabu mimo jiné díky zlepšení integrity epitelové bariéry umožňuje u části pacientů dosažení vícekomponentní remise těžkého astmatu s absencí exacerbací, užívání systémových kortikosteroidů (OCS), nízkým skóre příznaků (ACT větší než 20) a zlepšením plicních funkcí. Je k tomu ale nutná včasná identifikace a léčba pacientů s těžkým astmatem (před OCS) ze strany lékaře a eliminace bariér dosažení tohoto cíle u pacienta (zejm. adherence k léčbě a dodržování režimových opatření). MUDr. Heribanová se věnovala remodelačním změnám stěny bronchů u pacientů s těžkým astmatem. Připomenula, že postihují všechny vrstvy bronchiální stěny a zahrnují narušení integrity epitelu, hyperplazií pohárkových buněk, ztluštění bazální membrány, abnormity v extracelulární hmotě, subepiteliální fibrózu, hypertrofii hladkých svalů a angiogenezi. Upozornila, že již pozorovaný vliv biologické léčby na odvrácení remodelace dýchacích cest je nyní rozsáhle zkoumán. Mepolizumab na základě bronchiálních biopsií prokázal ve studiích MESILICO a REMOMEPO redukci objemu/plochy hladkých svalů, snížení tloušťky bazální membrány a zlepšení integrity epitelu dýchacích cest u pacientů s těžkým astmatem.
Remise astmatu – jak jí dosáhnout?
Přednášel doc. MUDr. Norbert Pauk, Ph.D.
Klinika pneumologie 3. LF UK a FN na Bulovce, Praha
Eliminace zánětu – nový ambiciózní cíl v léčbě těžkého astmatu
V terapii těžkého astmatu je remise novým pojmem. Odráží přechod od terapeutického přístupu zaměřeného na kontrolu astmatu k ambiocióznějšímu cíli osvobodit se od nemoci díky lepšímu cílení léčby a možné úplné eliminaci zánětu. Dosažení tohoto cíle ovšem brání řada překážek, jako je rezistence onemocnění, užívání OCS, komorbidity, zánět 2. typu aj.
Neléčený eozinofilní zánět a léčba OCS je u pacientů s těžkým astmatem spojena s dlouhodobými riziky. Zahrnují nejen plicní postižení, jako je např. ireverzibilní obstrukce, ale i postižení jiných orgánů a komorbidity, např. rinosinusitidu, gastroezofageální reflux (GERD), kardiovaskulární onemocnění, srdeční selhání, cerebrovaskulární onemocnění, úzkost/depresi, diabetes 2. typu, obezitu a osteoporózu1–6.
Role interleukinu 5 v patofyziologii astmatu
Zásadní patofyziologickou roli u astmatu hraje zánět, v 85 % případů zánět eozinofilní. U zánětu se uplatňuje řada cytokinů, přičemž jeho ústředním cytokinem je interleukin 5 (IL-5). Dysregulace IL-5 vede k dysfunkci epitelové bariéry7–9, imunitní nerovnováze10–12, zvýšené tvorbě hlenu13,14 remodelaci dýchacích cest9,15 a tvorbě nosních polypů16–20.
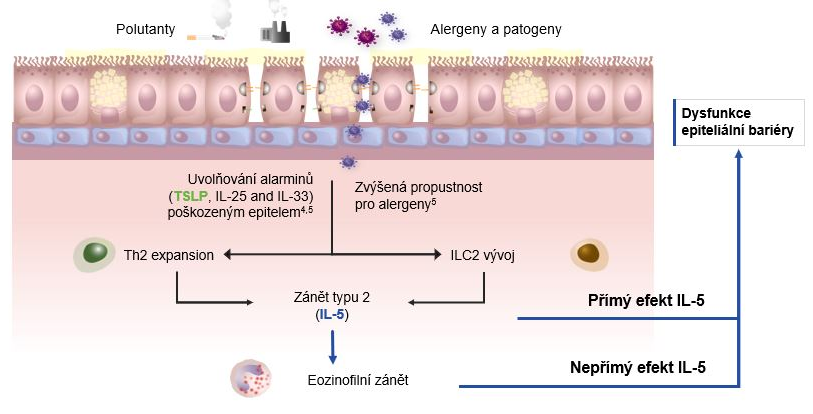
IL-5 stimulací eozinofilního zánětu poškozuje epitelovou bariéru. Nedávno byly nalezeny receptory pro IL-5 i na bronchiálních epitelových buňkách. Bylo zjištěno, že aktivace těchto receptorů vede k downregulaci genů zapojených do funkce epitelové bariéry a tvorby těsných spojů mezi epitelovými buňkami7,8,20. Porucha těchto mechanismů umožňuje průnik alergenů, event. jiných nežádoucích patogenů či polutantů (nox) do subepiteliálních vrstev bronchiální stěny (obr. 1)7,8,21–23.
Imunitní nerovnováha v důsledku dysregulace IL-5 je dána jeho modulačními účinky na expresi transkriptů zapojených do buněčného cyklu a proliferace plazmatických buněk24,25 podporou zrání eozinofilů, jejich chemotaxe, infiltrace, aktivace, degranulace a přežití26–33.
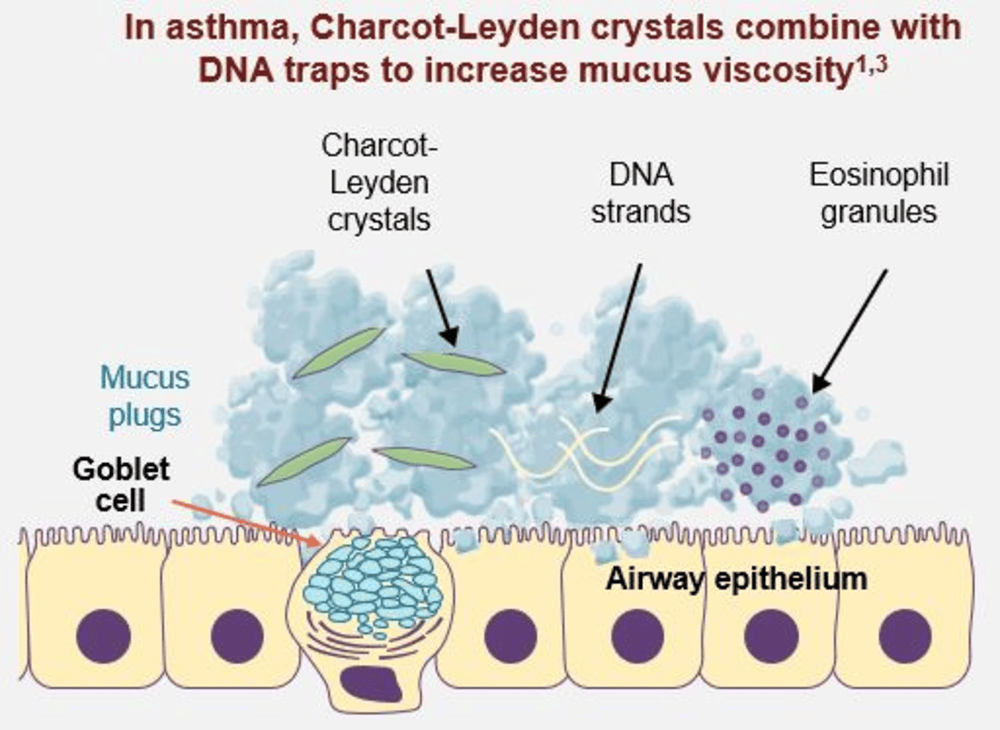
K tvorbě hlenových zátek významně přispívá tzv. tvorba EETs, která má za fyziologických podmínek antimikrobiální účinky, ale u těžkého astmatu se z obrovského množství zaniklých eozinofilů hromadí v lumen bronchů vlákna DNA a Charcot-Leydenovy krystaly, které zvyšují viskozitu hlenu v dýchacích cestách (obr. 2). Tyto hlenové zátky lze jen obtížně vykašlat. Přispívají tak k obstrukci dýchacích cest a snižují účinnost bronchodilatační léčby34–36.
Na základě bronchiálních biopsií bylo u pacientů s těžkým astmatem zjištěno zvýšené množství eozinofilů přímo v epitelu dýchacích cest. Analýza buněčného sedimentu indukovaného sputa ukázala, že exprese IL-5 v dýchacích cestách souvisí s přítomností intraepiteliálních eozinofilů, zatímco IL-4 a IL-13 nebyly významně zvýšené. IL-5 je tedy u pacientů s astmatem rozhodujícím faktorem pro infiltraci epitelu dýchacích cest eozinofily, což přispívá k zánětu 2. typu37.
U pacientů s těžkým astmatem existuje souvislost mezi počtem eozinofilů a poškozením epitelu. U jedinců s vysokým počtem eozinofilů je snížen podíl neporušeného epitelu. Eozinofilní zánět je tak ukazatelem poškození epitelu, což naznačuje, že zánět 2. typu způsobuje i ztrátu strukturální integrity dolních dýchacích cest38.
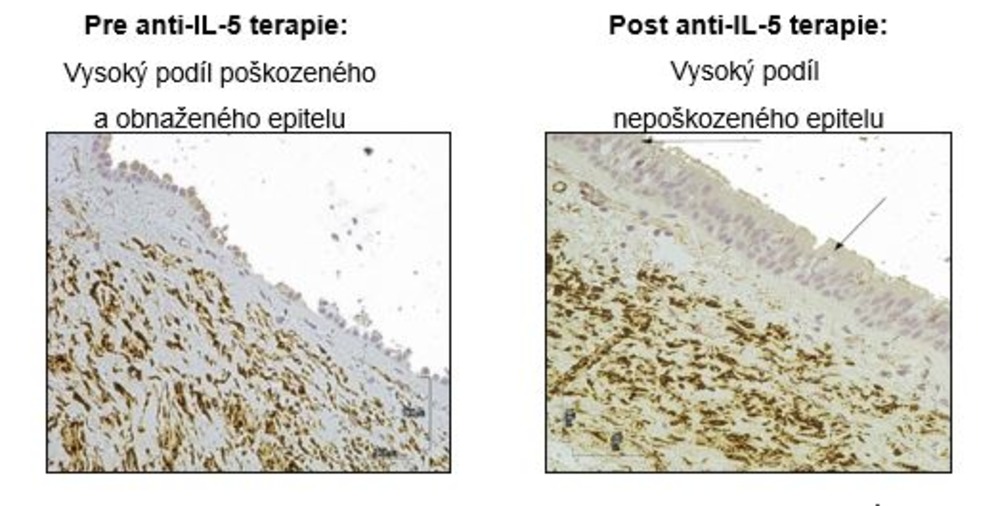
Inhibice IL-5 snižuje u pacientů s těžkým astmatem poškození bronchiálního epitelu a obnovuje integritu epitelové bariéry (obr. 3)9. Vzhledem k tomu, že poškození tohoto epitelu je hlavním znakem remodelace dýchacích cest, má inhibice IL-5 potenciál obnovit epitelovou bariéru směrem k normálnímu stavu9.
Možnost dosažení remise těžkého astmatu při biologické léčbě
Zásadním úkolem při léčbě astmatu je včas identifikovat pacienty s těžkým astmatem a rychle nasadit správnou léčbu. Pro identifikaci modifikovatelných rizik způsobených eozinofilním zánětem dýchacích cest se používá Oxfordská škála – ORACLE39, která zohledňuje počet eozinofilů, FENO (frakci vydechovaného NO), ve vztahu k výskytu exacerbací v posledním roce a přítomnost rizikových faktorů (špatná kontrola onemocnění, nízké plicní funkce, komorbidity, expozice alergenům a škodlivým látkám).
Cílem léčby je remise astmatu, která je, na rozdíl od kontroly onemocnění definované v krátkém časovém úseku, definována z dlouhodobého pohledu. Klinickou remisi lze posuzovat nejméně po 12 měsících trvající absence exacerbací a příznaků astmatu podle validovaného nástroje (ACQ skóre ≤ 0,75 nebo ACT skóre ≥ 20) na léčbě či bez léčby, s vysazením systémových kortikosteroidů jak pro léčbu exacerbací, tak pro dlouhodobou kontrolu onemocnění, a současně optimalizace či stabilizace plicních funkcí40.
Obr. 1. Poškození bronchiálního epitelu přímým a nepřímým působením IL-5 u těžkého astmatu7,8,21–23
Obr. 2. Zvýšení viskozity hlenu u těžkého astmatu v důsledku tvorby EETs eozinofilů34,36
Obr. 3. Zvýšení integrity bronchiálního epitelu po anti-IL-5 léčbě u těžkého astmatu9
Dosažení remise těžkého astmatu při léčbě mepolizumabem
Remise těžkého astmatu při biologické léčbě
Možnost dosažení remise těžkého astmatu při biologické léčbě hodnotila analýza dat z dánského registru. Z 501 pacientů bylo po 12 měsících léčby anti-IgE, anti-IL-5/R5, anti-IL-4 Rα protilátkami dosaženo odpovědi na léčbu (definované jako ≥ 50% pokles výskytu akutních exacerbací anebo užívání systémových kortikosteroidů) v 79 %. 24 % pacientů s odpovědí dosáhlo klinické remise definované jako vymizení exacerbací, absence užívání OCS, normalizace plicních funkcí a zlepšení výsledků v dotazníku kontroly astmatu41.
Remise těžkého astmatu při léčbě mepolizumabem
Konkrétně u protilátky proti IL-5, mepolizumabu, bylo v randomizovaných kontrolovaných studiích, dlouhodobých otevřených studiích
Obr. 4. Podíl pacientů s těžkým astmatem s dosažením kritérií remise po 1 roce léčby mepolizumabem ve studii REDES46
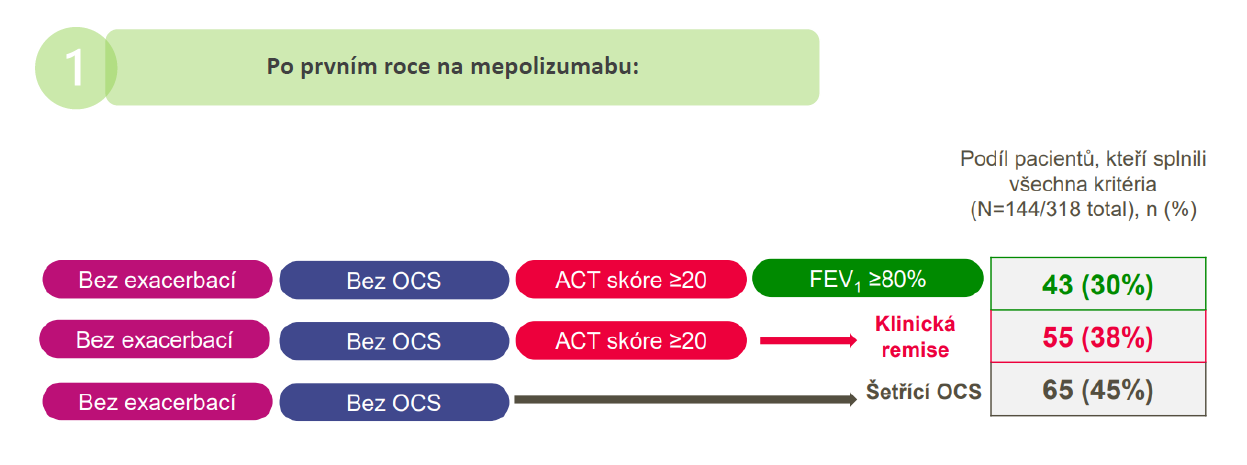
i studiích provedených v reálné praxi prokázáno, že u většiny pacientů s těžkým astmatem vede k dlouhodobé kontrole exacerbací a snížení užívání OCS42,43, zlepšuje kvalitu života pacientů44 a u části léčených pacientů dosahuje i zlepšení plicích funkcí (u 13–30 %)45,46. Ve španělské studii REDES dosáhlo během 1 roku léčby mepolizumabem 30 % (143 z 318) pacientů s těžkým astmatem remise definované 4 parametry: absence exacerbací, absence užívání OCS, ACT skóre ≥ 20 a FEV1 ≥ 80 % (4komponentní remise) (obr. 4)46.
Ve studii REALITI-A47 zahrnující pacienty s těžkým astmatem léčené mepolizumabem bylo hodnoceno dosažení 3komponentní remise definované jako absence exacerbací po celých 24 měsíců léčby, absence užití OCS během 24. měsíce léčby a skóre ACQ-5 < 1 nebo < 1,5 po 24 měsících léčby. Po 2 letech užívalo mepolizumab stále 76 % zařazených. Z 81 pacientů se všemi dostupnými daty bylo dosaženo této 3komponentní remise ve 37 % (pro ACQ-5 < 1), resp. ve 44 % (pro ACQ-5 < 1,5. Nižší pravděpodobnost dosažení 3komponentní remise měli pacienti, kteří při vstupu do studie užívali OCS, měli ≥ 4 akutní exacerbace za poslední rok před nasazením mepolizumabu, vstupní ACQ-5 ≥ 2 anebo BMI ≥ 30 kg/m247. Obtížnější dosažení remise astmatu u pacientů s pokročilým onemocněním podtrhují význam časného nasazení biologické léčby astmatu.
České zkušenosti
Výskyt komorbidit u 137 pacientů s těžkým astmatem na biologické léčbě sledovaných ve FN Bulovka ukazuje přítomnost obezity ve 29 %, chronické rinosinusitidy s případnými polypy ve 26 %, deprese/úzkosti v 5 %, diabetu ve 22 %, GERD ve 27 % a užívání OCS ve 20 %. V poslední době ale podíl pacientů odesílaných do centra k biologické léčbě na OCS klesá, zhruba na 5 - 10 %, což svědčí o snaze ambulantních lékařů zasáhnout u těžkého astmatu včas pomocí biologické léčby. Biologická léčba vedla u souboru pacientů s těžkým astmatem ve FN Bulovka k redukci užívání OCS ve 100 % případů, přičemž 70 % pacientů vysadilo OCS do 1 roku od zahájení biologické léčby, u 80 % léčených došlo k redukci exacerbací astmatu, změna biologické léčby byla nutná v 10 % případů a u 35 % bylo dosaženo klinické remise včetně zlepšení plicních funkcí.
Překonání bariér dosažení remise u těžkého astmatu
Dle expertního konsenzu GINA z roku 202448 zahrnují rizikové faktory exacerbací a ztráty plicních funkcí u pacientů s astmatem nadužívání SABA, nízkou adherenci k léčbě inhalačními kortikosteroidy anebo špatnou inhalační techniku, komorbidity (GERD, obezita, psychiatrická onemocnění), přetrvávající expozici spouštěčům (kouření, alergeny, polutanty), psychosociální problémy, zhoršení plicních funkcí s FEV1 < 60 % náležitých hodnot, známky zánětu 2. typu a anamnézu těžkých exacerbací s intubací či přijetím na JIP.
Výskyt některých z těchto rizikových faktorů může ovlivnit lékař. Na základě anamnézy, funkčního vyšetření plic, známek zánětu a komorbidit by měl správně stanovit diagnózu, provést zhodnocení tíže a fenotypizaci astmatu, nastavit léčbu, edukovat pacienta a doporučit režimová opatření, monitorovat léčbu, kontrolovat léčbu komorbidit a dosáhnout dobré komunikace s nemocným. Rizikové faktory jsou samozřejmě dány i charakteristikami pacienta, a to neovlivnitelnými (věk, ženské pohlaví, délka trvání onemocnění, věk při vzniku příznaků, deprese, zánět 2. typu, skóre ACQ ≥ 1,5), ale i ovlivnitelnými, jako je adherence k léčbě, inhalační technika, dodržování režimových opatření či snížení nadváhy.
Závěr
Remise těžkého astmatu je ambiciózní cíl. Umožňuje jej biologická léčba, zejména zacílení na klíčový cytokin v patogenezi onemocnění – IL-5, které nabízí mepolizumab.
IL-5 a remodelace
MUDr. Lucie Heribanová
Pneumologická klinika 1. LF UK a FTN, Praha
Cíle v léčbě těžkého astmatu by měly být ambiciózní, ale současně i realistické. Klinická remise je dnes díky biologické léčbě dosažitelným cílem léčby. I u pacientů bez dosažení remise ale přináší biologická léčba včetně inhibitorů IL-5 výrazné zlepšení kvality života.
Remodelační změny dýchacích cest u těžkého astmatu
Dlouhodobá rizika spojená s astma bronchiale zahrnují obtíže vyplývající z tíže onemocnění samotného (exacerbace, remodelace stěny bronchů s trvalým snížením plicních funkcí), a dále obtíže vyplývající z nežádoucích účinků léčby a z komorbidit. U většiny pacientů s těžkým astmatem se pomocí biologické léčby daří snížit výskyt a tíži exacerbací a rizika spojená s užíváním léčby (zejm. s OCS) a s komorbiditami. Otázkou je možnost odvrácení remodelačních změn, které vedou často k trvalému a progredujícími snížení plicních funkcí.
Remodelační změny postihují všechny vrstvy stěny dýchacích cest. Začínají narušením integrity epitelu a hyperplazií pohárkových buněk, pokračující ztluštěním bazální membrány a odchylkami v extracelulární hmotě a ústí v subepiteliální fibrózu, hypertrofii a hyperplazii hladkých svalů a angiogenezi (obr. 5)49.
Remodelační proces spouští zřejmě epitel s významnou úlohou tzv. epitelo-mezenchyální tranzice (EMT). V tomto procesu se uplatňuje především TGF-β (transformující růstový faktorβ), ale i IL-4, IL-13, IL-10, EGF (epidermální růstový faktor), VEGF (vaskulární endotelový růstový faktor), PDGF (růstový faktor z destiček) a další růstové faktory a chemokiny. Imunitní buňky, např. eozinofily, mají na rozvoj remodelačních změn jednak přímý vliv (např. produkce TGF-β, extracelulární hmoty), ale především vliv nepřímý cestou vyplavovaných cytokinů a lipidových mediátorů.
Obr. 5. Remodelace dýchacích cest u astma bronchiale49
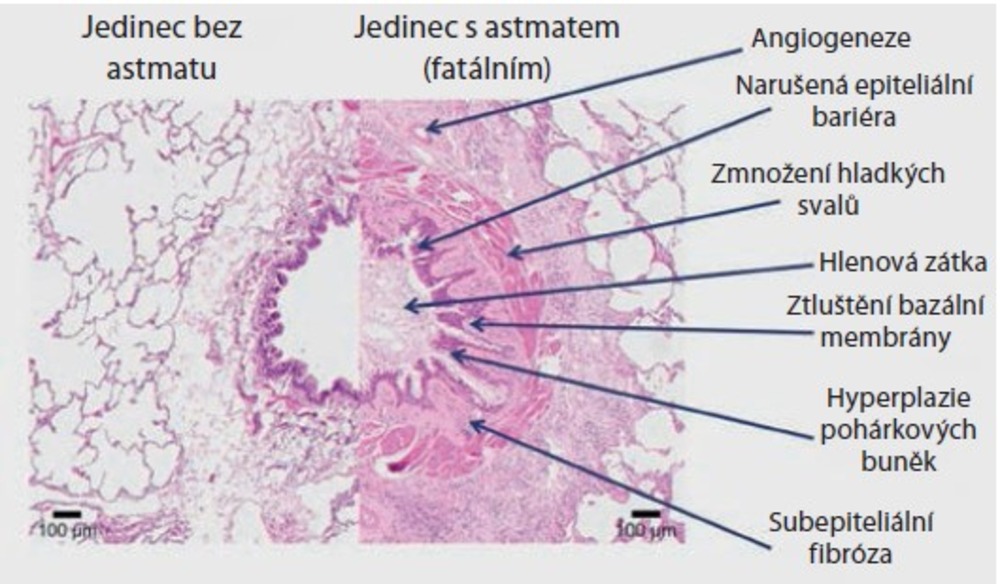
Na remodelaci se podílejí i neimunitní mechanismy zcela nezávislé na imunitních buňkách50.
Změny epitelu zahrnují ztrátu ciliárních buněk a hyperplazii pohárkových buněk s následnou zvýšenou produkcí hlenu a některých cytokinů a dále narušení integrity epitelu, které souvisí s uvolněním TGF-β a dalších růstových faktorů. Úprava integrity epitelu dýchacích cest byla při biologické léčbě těžkého astmatu již prokázána51.
TGF-β je hlavním mediátorem EMT neboli přeměny epiteliálních buněk sliznice dýchacích cest na mezenchymální s následnou přeměnou na fibroblasty a myofibroblasty, které se podílejí na rozvoji hypertrofie hladké svaloviny52.
Dochází také k remodelaci bazální membrány, a to ve smyslu ztluštění a převahy kolagenu typu I a III namísto normálně převažujícího typu IV a zmnožení fibronektinu53. V tomto případě může jít o adaptační změnu, protože právě kolagen typu I a II a fibronektin usnadňují tvorbu a obnovu funkčního epitelu. Nejzávažnější remodelační změnou je hypertrofie a hyperplazie hladkých svalových buněk stěny dýchacích cest. Bronchokonstrikce je pravděpodobně jedním ze spouštěčů remodelace nezávislým na zánětu, a to prostřednictvím navozené produkce TGF-β epiteliálními buňkami54. Buňky hladké svaloviny navíc produkují proteiny extracelulární matrix, prozánětlivé cytokiny, chemokiny a růstové faktory (včetně TGF-β), integriny a adhezivní molekuly, takže se aktivně účastní celého remodelačního procesu54. Biologická léčba může přímo ovlivnit kontraktilitu hladkých svalových buněk dýchacích cest, protože tyto buňky exprimují receptory pro IgE, IL-4, IL-13 a thymický stromální lymfopoetin.
Vliv biologické léčby na remodelaci dýchacích cest
Vliv biologické léčby na remodelační změny bronchiální stěny je vysvětlován potlačením zánětu55,56. Tento její efekt bude ale zřejmě širší a je předmětem zkoumání, protože dlouhodobý vliv na plicní funkce v neselektované populaci není důkazem vlivu na remodelační změny57. Efekt benralizumabu je zkoumán ve studii CHINOOK, tezepelumabu ve studii REVERT, dupilumabu ve studii VESTIGO a mepolizumabu ve studiích MESILICO a REMOMEPO.
Mepolizumab je humanizovaná monoklonální protilátka proti IL-5, který hraje zásadní roli v produkci, diferenciaci, migraci, aktivaci a délce přežití eozinofilů a funguje jako pozdní faktor jejich diferenciace57. Eozinofily úzce souvisejí s remodelací dýchacích cest, protože jsou silným lokálním zdrojem TGF-β1 ve vrstvě pod bazální membránou.
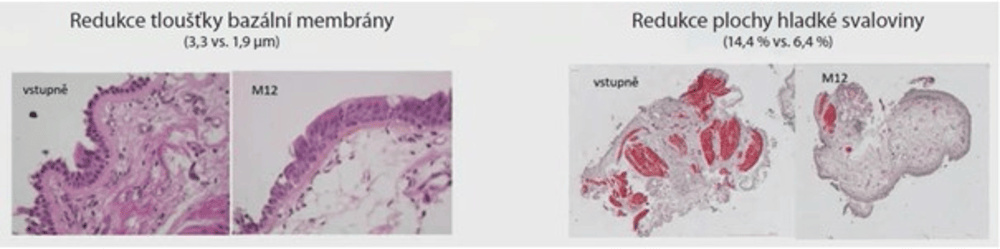
Obr. 6. Efekt 12měsíční léčby mepolizumabem na tloušťku bazální membrány a procentuální velikost plochy hladkých svalů v biopsii bronchiální sliznice pacientů s astmatem15
V těchto hlubších vrstvách bronchiální stěny jsou eozinofily spolu s makrofágy dokonce hlavním zdrojem TGF-β1. Dále eozinofily produkují řadu cytokinů včetně IL-4 a IL-13, které se podílejí na remodelaci bronchiální stěny58.
Již v roce 2003 byl zkoumán potenciální vliv mepolizumabu na ukládání proteinů extracelulární hmoty v subepiteliální bazální membráně bronchů u pacientů s astmatem. Jednalo se o placebem kontrolovanou studii zahrnující 24 pacientů s lehkým astmatem, kteří podstoupili bronchiální biopsii před zahájením léčby mepolizumabem a po 10 týdnech této léčby. I po takto krátkém časovém období léčby ukázaly výsledky pokles exprese některých proteinů extracelulární hmoty v bazální membráně a významné snížení produkce TGF-β1 eozinofily v dýchacích cestách59. K podobným zjištěním vedla i řada experimentálních studií u zvířat.
Předběžná data ze studie MESILICO zahrnující 47 pacientů s těžkým eozinofilním astmatem, kteří podstoupili biopsii bronchiální sliznice před zahájením a po 12 měsících léčby mepolizumabem, ukázala redukci objemu hladkých svalů v dýchacích cestách, snížení tloušťky lamina reticularis bazální membrány a zlepšení integrity epitelu dýchacích cest9. V této studii nebyla zjištěna korelace mezi plicními funkcemi FEV1 a tíží remodelačních změn.
Do studie REMOMEPO bylo zařazeno 23 pacientů, kteří podstoupili bronchiální biopsii a bronchoalveolální laváž před zahájením léčby mepolizumabem a po 6 a 12 měsících této léčby. Studie hodnotila změnu tloušťky bazální membrány a procentuální velikost plochy hladkých svalů v biopsii bronchiální sliznice. Výsledky ukázaly zmenšení tloušťky bazální membrány průměrně ze 3,3 µm na 1,9 µm a pokles plochy hladké svaloviny z průměrných 14,4 % na 6,4 % po 12 měsících léčby mepolizumabem (obr. 6)15.
Ani v této studii nebyl příznivý vliv na odvrácení remodelace dýchacích cest při léčbě mepolizumabem provázen statisticky významnou změnou FEV1. To může být dáno výběrem nevhodného parametru (FEV1) pro hodnocení vlivu biologické léčby na plicní funkce, nebo výsledkem dlouhodobě probíhajících remodelačních změn v průběhu onemocnění vzniklého např. již v dětství. Jestliže je doloženo, že biologická léčba dokáže příznivě ovlivnit již vzniklé remodelační změny bronchů u astmatu, je velmi pravděpodobné, že dokáže zabránit i jejich progresi.
Zkoumán byl i vliv inhalačních kortikosteroidů (ICS) na remodelační změny stěny bronchů. Ačkoliv mají ICS příznivý vliv na poškození epitelu potlačením zánětu, longitudinální studie ukázaly, že poškození plicních funkcí přítomné v dětství přetrvává navzdory léčbě ICS a bronchodilatancii. I přes nesporný efekt ICS na chronický zánět a v praxi pozorovanou prevenci remodelace dýchacích cest je jejich přímý významný účinek na přítomnou remodelaci sporný.
Závěr
V současné době jsou k dispozici důkazy, které svědčí pro možnost ovlivnění remodelačních změn dýchacích cest biologickou léčbou, včetně protilátek proti IL-5. Příznivý vliv mepolizumabu na odvrácení bronchiální remodelace ukázaly studie MESILICO a REMOMEPO.
Zdroje:
- Price DB, Trudo F, Voorham J, et al. Adverse outcomes from initiation of systemic corticosteroids for asthma: long-term observational study. J Asthma Allergy. 2018 Aug 29; 11: 193-204.
- Iribarren C, Tolstykh IV, Miller MK, et al. Adult asthma and risk of coronary heart disease, cerebrovascular disease, and heart failure: a prospective study of 2 matched cohorts. Am J Epidemiol. 2012 Dec 1; 176(11): 1014-1024.
- Reddel HK, Bacharier LB, Bateman ED, et al. Global Initiative for Asthma Strategy 2021: executive summary and rationale for key changes. Eur Respir J. 2021 Dec 31; 59(1): 2102730.
- Patel GB, Peters AT. Comorbidities associated with severe asthma. J Precis Respir Med. 2019 Dec; 2(1): 5-9.
- Wang E, Wechsler ME, Tran TN, et al. Characterization of Severe Asthma Worldwide: Data From the International Severe Asthma Registry. Chest. 2020 Apr; 157(4): 790-804.
- Busse WW, Melén E, Menzies-Gow AN. Holy Grail: the journey towards disease modification in asthma. Eur Respir Rev. 2022 Feb 22; 31(163): 210183.
- Buchheit KM, Lewis E, Gakpo D, et al. Mepolizumab targets multiple immune cells in aspirin-exacerbated respiratory disease. J Allergy Clin Immunol. 2021 Aug; 148(2): 574-584.
- Rakkar K, Pang YL, Rajasekar P, et al. Mepolizumab-induced Changes in Nasal Methylome and Transcriptome to Predict Response in Asthma. Am J Respir Crit Care Med. 2024 May 15; 209(10): 1268-1272.
- Domvri K et al. Effect of Mepolizumab on airways remodeling in patients with late-on- set severe eosinophilic asthma and fixed obstruction (preliminary data of the MESILICO study). Poster and Presentation 3152. ERS International Congress, 9-13 September, 2023.
- Bergantini L, d‚Alessandro M, Cameli P, et al. Regulatory T cell monitoring in severe eosinophilic asthma patients treated with mepolizumab. Scand J Immunol. 2021 Jul; 94(1): e13031.
- Bergantini L, Pianigiani T, d‚Alessandro M, et al. The effect of anti-IL5 monoclonal antibodies on regulatory and effector T cells in severe eosinophilic asthma. Biomed Pharmacother. 2023 Oct; 166: 115385.
- Malik B, Bartlett NW, Upham JW, et al. Severe asthma ILC2s demonstrate enhanced proliferation that is modified by biologics. Respirology. 2023 Aug; 28(8): 758-766.
- Hamakawa M, Ishida T. Usefulness of Mepolizumab for Mucus Plugs. Intern Med. 2024 Mar 25. doi: 10.2169/internalmedicine.3531-3524. Epub ahead of print.
- Tomomatsu K, Yasuba H, Ishiguro T, et al. Real-world efficacy of anti-IL-5 treatment in patients with allergic bronchopulmonary aspergillosis. Sci Rep. 2023 Apr 4; 13(1): 5468.
- Taille C. Impact of mepolizumab on airway remodelling in severe eosinophilic asthma. Am J Respir Crit Care. Med 2024; 209: A1051.
- Chen YS, Langhammer T, Westhofen M, Lorenzen J. Relationship between matrix metalloproteinases MMP-2, MMP-9, tissue inhibitor of matrix metalloproteinases-1 and IL-5, IL-8 in nasal polyps. Allergy. 2007 Jan; 62(1): 66-72.
- Tomassen P, Vandeplas G, Van Zele T, et al. Inflammatory endotypes of chronic rhinosinusitis based on cluster analysis of biomarkers. J Allergy Clin Immunol. 2016 May; 137(5): 1449-1456.e4.
- De Corso E, Baroni S, Settimi S, et al. Sinonasal Biomarkers Defining Type 2-High and Type 2-Low Inflammation in Chronic Rhinosinusitis with Nasal Polyps. J Pers Med. 2022 Jul 29; 12(8): 1251.
- Rosati D, Rosato C, Pagliuca G, et al. Predictive markers of long-term recurrence in chronic rhinosinusitis with nasal polyps. Am J Otolaryngol. 2020 Jan-Feb; 41(1): 102286.
- Calus L, Van Bruaene N, Bosteels C, et al. Twelve-year follow-up study after endoscopic sinus surgery in patients with chronic rhinosinusitis with nasal polyposis. Clin Transl Allergy. 2019 Jun 14; 9: 30.
- Barretto KT, Brockman-Schneider RA, Kuipers I, et al. Human airway epithelial cells express a functional IL-5 receptor. Allergy. 2020 Aug; 75(8): 2127-2130.
- Pelaia C, Pelaia G, Maglio A, et al. Pathobiology of Type 2 Inflammation in Asthma and Nasal Polyposis. J Clin Med. 2023 May 9; 12(10): 3371.
- Russell RJ, Boulet LP, Brightling CE, et al. The airway epithelium: an orchestrator of inflammation, a key structural barrier and a therapeutic target in severe asthma. Eur Respir J. 2024 Apr 4; 63(4): 2301397.
- Buchheit KM, Dwyer DF, Ordovas-Montanes J, et al. IL-5Rα marks nasal polyp IgG4- and IgE-expressing cells in aspirin-exacerbated respiratory disease. J Allergy Clin Immunol. 2020 Jun; 145(6): 1574-1584.
- Sohail A, Hacker J, Ryan T, et al. Nasal polyp antibody-secreting cells display proliferation signature in aspirin-exacerbated respiratory disease. J Allergy Clin Immunol. 2024 Feb; 153(2): 527-532.
- Stirling RG, van Rensen EL, Barnes PJ, Chung KF. Interleukin-5 induces CD34(+) eosinophil progenitor mobilization and eosinophil CCR3 expression in asthma. Am J Respir Crit Care Med. 2001 Oct 15; 164(8 Pt 1): 1403-1409.
- Rimkunas A, Januskevicius A, Vasyle E, et al. Effect of IL-3, IL-5 and GM-CSF on adhesion and chemotaxis of blood eosinophil subtypes in allergic asthma. European respiratory journal : ERS International congress 2022 abstracts: Barcelona, Spain, 4-6 September, 2022 / Europe- an Respiratory Society (ERS). Sheffield : European Respiratory Society, 2022, vol. 60, suppl. 66.
- Luo J, Chen W, Liu W, et al. IL-5 antagonism reverses priming and activation of eosinophils in severe eosinophilic asthma. Mucosal Immunol. 2024 Aug; 17(4): 524-536.
- Shi H, Qin S, Huang G, et al. Infiltration of eosinophils into the asthmatic airways caused by interleukin 5. Am J Respir Cell Mol Biol. 1997 Mar; 16(3): 220-224.
- akafuji S, Tadokoro K, Ito K. Effects of interleukin (IL)-3 and IL-5 on human eosinophil degranulation induced by complement components C3a and C5a. Allergy. 1996 Aug; 51(8): 563-568.
- Lee MH, Choi JW, Jang WR, et al. Activation of eosinophils is more closely linked with interleukin-5 and nitric oxide production than tumor necrosis factor-α and immunoglobulin E levels. Acta Haematol. 2013; 130(4): 238-241.
- Koranteng J, Raby K, Dixey P, et al. Role of eosinophil mitochondrial function in severe eosinophilic asthma. European Respiratory Journal 2023 62: PA552.
- Xu J, Jiang F, Nayeri F, Zetterström O. Apoptotic eosinophils in sputum from asthmatic patients correlate negatively with levels of IL-5 and eotaxin. Respir Med. 2007 Jul; 101(7): 1447-1454.
- Howell I, Howell A, Pavord ID. Type 2 inflammation and biological therapies in asthma: Targeted medicine taking flight. J Exp Med. 2023 Jul 3; 220(7): e20221212.
- Ueki S, Konno Y, Takeda M, et al. Eosinophil extracellular trap cell death-derived DNA traps: Their presence in secretions and functional attributes. J Allergy Clin Immunol. 2016 Jan; 137(1): 258-267.
- Persson EK, Verstraete K, Heyndrickx I, et al. Protein crystallization promotes type 2 immunity and is reversible by antibody treatment. Science. 2019 May 24; 364(6442): eaaw4295.
- Al-Shaikhly T, Murphy RC, Parker A, et al. Location of eosinophils in the airway wall is critical for specific features of airway hyperresponsiveness and T2 inflammation in asthma. Eur Respir J. 2022 Aug 4; 60(2): 2101865.
- Wilson SJ, Rigden HM, Ward JA, et al. The relationship between eosinophilia and airway remodelling in mild asthma. Clin Exp Allergy. 2013 Dec; 43(12): 1342-1350.
- Couillard S, Laugerud A, Jabeen M, et al. Derivation of a prototype asthma attack risk scale centred on blood eosinophils and exhaled nitric oxide. Thorax. 2022 Feb; 77(2): 199-202.
- Menzies-Gow A, Bafadhel M, Busse WW, et al. An expert consensus framework for asthma remission as a treatment goal. J Allergy Clin Immunol. 2020 Mar; 145(3): 757-765.
- Hansen S, Baastrup Søndergaard M, von Bülow A, et al. Clinical Response and Remission in Patients With Severe Asthma Treated With Biologic Therapies. Chest. 2024 Feb; 165(2): 253-266.
- Cristiano Caruso, International, prospective study of mepolizumab in severe asthma: REALITI-A at 2yr. Abstract number: PA4186. Presented at ERS 2022, 4–6 September, 2022.
- Khurana S, Brusselle GG, Bel EH, FitzGerald JM, et al. Long-term Safety and Clinical Benefit of Mepolizumab in Patients With the Most Severe Eosinophilic Asthma: The COSMEX Study. Clin Ther. 2019 Oct; 41(10): 2041-2056.e5.
- Chupp GL, Bradford ES, Albers FC, et al. Efficacy of mepolizumab add-on therapy on health-related quality of life and markers of asthma control in severe eosinophilic asthma (MUSCA): a randomised, double-blind, placebo-controlled, parallel-group, multicentre, phase 3 b trial. Lancet Respir Med. 2017 May; 5(5): 390-400.
- Kallieri M, Zervas E, Fouka E, et al. RELIght: A two-year REal-LIfe study of mepolizumab in patients with severe eosinophilic asTHma in Greece: Evaluating the multiple components of response. Allergy. 2022 Sep; 77(9): 2848-2852.
- Pavord I, Gardiner F, Heaney LG, et al. Remission outcomes in severe eosinophilic as- thma with mepolizumab therapy: Analysis of the REDES study. Front Immunol. 2023 Apr 12; 14: 1150162.
- Guy Brusselle (Ghent, Belgium), Diane Lougheed, Giorgio Walter Canonica, et al. Clinical characteristics impacting clinical remission attainment in REALITI-A. PA1200. Prezentováno na kongresu ERS 2024.
- 2024 GINA main report. Dostupné na: https://ginasthma.org/2024-report/.
- Hsieh A, Assadinia N, Hackett TL. Airway remodeling heterogeneity in asthma and its relationship to disease outcomes. Front Physiol. 2023 Jan 19; 14: 1113100.
- Savin IA, Zenkova MA, Sen‚kova AV. Bronchial Asthma, Airway Remodeling and Lung Fibrosis as Successive Steps of One Process. Int J Mol Sci. 2023 Nov 7; 24(22): 16042.
- Bayarri MA, Milara J, Estornut C, Cortijo J. Nitric Oxide System and Bronchial Epithelium: More Than a Barrier. Front Physiol. 2021 Jun 30; 12: 687381.
- Saglani S, Malmström K, Pelkonen AS, et al. Airway remodeling and inflammation in symptomatic infants with reversible airflow obstruction. Am J Respir Crit Care Med. 2005 Apr 1; 171(7): 722-727.
- Mottais A, Riberi L, Falco A, et al. Epithelial-Mesenchymal Transition Mechanisms in Chronic Airway Diseases: A Common Process to Target? Int J Mol Sci. 2023 Aug 3; 24(15): 12412.
- Wawruch M, Murin J, Tesar T, et al. Reinitiation and Subsequent Discontinuation of Antiplatelet Treatment in Nonpersistent Older Patients with Peripheral Arterial Disease. Biomedicines. 2021 Sep 21; 9(9): 1280
- Domvri K, Porpodis K. Targeting inflammation or remodeling in asthma? Is there a right way? Front Med (Lausanne). 2023 Nov 23; 10: 1241920.
- Varricchi G, Ferri S, Pepys J, et al. Biologics and airway remodeling in severe asthma. Allergy. 2022 Dec; 77(12): 3538-3552.
- Pelaia C, Vatrella A, Busceti MT, et al. Severe eosinophilic asthma: from the pathogenic role of interleukin-5 to the therapeutic action of mepolizumab. Drug Des Devel Ther. 2017 Oct 30; 11: 3137-3144.
- Novosad J, Krčmová I. Role eozinofilů v patogenezi, diagnostice a léčbě bronchiálního astmatu. Vnitřní lékařství. 2023; 69 (6): 365–372.
- Flood-Page P, Menzies-Gow A, Phipps S, Ying S, et al. Anti-IL-5 treatment reduces deposition of ECM proteins in the bronchial subepithelial basement membrane of mild atopic asthmatics. J Clin Invest. 2003 Oct; 112(7): 1029-1036.
Nucala je registrovaná ochranná známka koncernu GlaxoSmithKline
Případná podezření na nežádoucí účinky nám prosím hlaste na cz.safety@gsk.com
Výdej léčivého přípravku je vázán na lékařský předpis. Léčivý přípravek je hrazen z prostředků zdravotního pojištění v indikaci léčby těžkého refrakterního eozinofilního astmatu u dospělých pacientů. Před předepsáním léku se, prosím, seznamte s úplnou informací o přípravku, kterou najdete v Souhrnu údajů o přípravku (SPC) na www.gskkompendium.cz, nebo se obraťte na společnost GlaxoSmithKline, s. r. o.,
Zkrácená informace o přípravku
Příbalové informace
© 2024 Skupina společností GSK nebo držitel licence. Všechny uvedené ochranné známky jsou majetkem jejich příslušných vlastníků.
Přípravek Nucala je pro indikaci těžkého refrakterního eozinofilního astmatu schválen jako doplňková léčba u dospělých, dospívajících a dětí ve věku minimálně šesti let.1
U pacientů ve věku 12 a více let je licencován pouze přípravek Nucala 100 mg s.c.
U pacientů ve věku 6–11 let je licencován pouze přípravek Nucala 40 mg s.c.
PM-CZ-MPL-WCNT-240008
Datum přípravy: prosinec 2024





